|
Agrégation 2006 : agitation thermique d'un gaz ; énergie interne ; capacités thermiques En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptés à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
L'agitation thermique est le mouvement aléatoire des particules constituant le gaz. Ce mouvement est du à l'énergie microscopique des particules. Définition du kelvin, unité de température thermodynamique, à partir du point triple de l'eau : point triple de l'eau : TT(eau) = 273,16 K ; 1 K= TT(eau) / 273,16 Vitesse quadratique moyenne v* des particules d'un gaz : énergie cinétique moyenne de translation <Ec>=½ m<v2>= ½ mv*2 = 3/2 kT d'où v* = [3kT/m]½. Mouvement brownien : à l'échelle du microscope optique, mouvement aléatoire de particules sous l'action de collisions. Libre parcours moyen l en fonction du nombre n de particules par unité de volume et de leur section efficace de collision s : Pendant la durée t entre deux collisions, une particule animée de la vitesse v*, balaye le volume v*ts ; de plus le libre parcours moyen est l = v*t. Nombre de particule présent dans ce volume N = n v*ts =n ls =1 ( entre deux collisions). Par suite l = 1/(ns)
masse d'une particule : m= M/NA=29 10-3 / 6,02 1023 = 4,82 10-26 kg. Vitesse quadratique moyenne v* = [3kT/m]½ =[3*1,38 10-23 *300/4,82 10-26 ]½=507 m/s. Nombre de particules n par unité de volume : PV = n kT avec V= 1 m3. n = P/(kT)= 105/(1,38 10-23 *300) = 2,4 1025 espèces par m3. Distance moyenne d entre les molécules : n d3 = 1 soit d = 1/n1/3 = 1/(2,4 1025)1/3 =3,5 10-9 m = 3,5 nm. section efficace de collision s : La taille des molécules est de l'ordre de 2 à 3 10-10 m ; s est de l'ordre de 10-19 m2. Libre parcours moyen l : l = 1/(ns) =1/( (2,4 1025 *10-19)=4,2 10-7 m= 420 nm. durée moyenne t entre deux chocs : t = l /v* =4,2 10-7 /507 = 8 10-10 s = 0,8 ns.
|
|
|
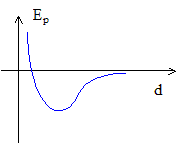
Energie interne : énergie cinétique et potentielle microscopiques d'un corps. Capacité thermique Cv à volume constant : Cv = [dU/dT]V. La capacité thermique d'un liquide ou d'un solide peut être déterminée par calorimétrie : Placer dans le calorimètre, une masse m d'un liquide de capacité thermique c connue à la température q ; y ajouter une masse m' de liquide ou de solide, à la température q ', de capacité thermique c' inconnue. A l'équilibre thermique la température est q éq et : mc(q éq -q ) + m'c'(q éq -q ') =0. Thermostat : la température d'un thermostat reste constante ; sa capacité thermique est très grande, voir infinie. Energie cinétique moyenne d'une particule d'un gaz parfait monoatomique : <Ec> =3/2 kT. Energie interne U d'un gaz parfait monoatomique compenant N particules : U= N<Ec> = 3/2 NkT Sa capacité thermique Cv molaire à volume constant vaut : Cv = [dU/dT]V = 3/2kN = 3/2 R. L'énergie interne d'un gaz réel prend en compte l'énergie potentielle d'interaction entre particules ; l'énergie potentielle dépend de la distance d entre particules ; cette distance d dépend du volume : l'énergie interne d'un gaz réel dépend donc du volume.
On note m la masse d'un atome. Puisque la molécule est susceptible de vibrer, la distance interatomique d varie dans le temps autour de sa valeur moyenne d0. Expression de l'énergie cinétique totale de la molécule en fonction de sa vitesse de translation, de sa vitesse de rotation notée W selon un axe normal à la molécule et de d : Ec = ½(2m)v2 + ½JW2+0,25 m d'2 avec J= ½md02. Expression de l'énergie potentielle de la molécule en fonction de m et f0 la fréquence de vibration de la molécule : On modélise l'interaction inter-atomique par un oscillateur élastique de constante de raideur K Ep = ½K (d-d0)2 ; l'origine de cette énergie est prise à d=d0 ; de plus f0 = 1/(2p) [K/m]½ avec m : masse réduite m = ½m. K= (f02p)2m d'où Ep= 0,25m (f02p)2(d-d0)2 = m(f0p)2(d-d0)2. Nombre de degrés de liberté énergétique de la molécule diatomique : 3 pour la translation, 2 pour la rotation de la molécule linéaire, 2 pour les énergies de vibration. Chaque degré apporte l'énergie ½kT à l'énergie moyenne de la molécule ; si tous les degrés de liberté de la molécule diatomique étaient excités, l'énergie interne d'un gaz parfait constitué de N molécules serait : U= 7/2NkT ; la capacité thermique molaire Cv serait Cv = 7/2 R. Relation entre la capacité thermique molaire à pression constante Cp et Cv pour un gaz parfait : Cp = Cv + R. A température ambiante, la molécule tourne sur elle même mais ne vibre pas : Cv = 5/2 R ; Cp = Cv + R= 7/2 R ; L'air étant contitué de molécules linéaires ( O2, N2, CO2 ), pour ce dernier g= Cp/Cv =7/5 = 1,4. |
|
|
|