|
Etude et exploitation du diagramme E=f(pCN) de l'or : cyanuration de l'or BTSchimiste 2008. En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
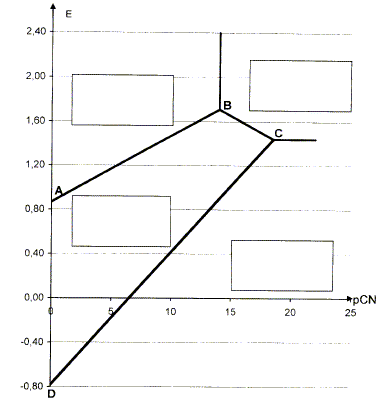
On donne le diagramme E= f(pCN). Il fait intervenir les nombres d'oxydation 0, I et III de l'or. Ce diagramme a été établi pour une température de 298 K et une condition de concentration pour chaque espèce soluble de l'élément or sur une frontière telle que : c= 1,0 10-3 mol/L.
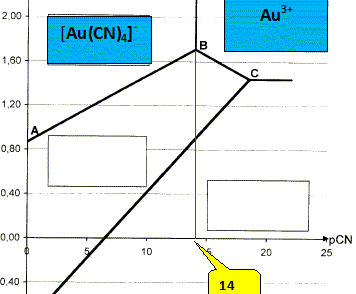
Calculer la valeur de pCN sur la frontière correspondant au système [Au(CN)4]- /Au3+. On donne la constante de formation globale du complexe [Au(CN)4]- : log b4 =56. sur la frontière [
[Au(CN)4]-]
= [Au3+] par suite : log b4
=-4 log [CN-] = 4 pCN =
56 ; pCN =
14. Le complexe prédomine lorsque [CN-] est élevé, c'est à dire pCN faible : donc à gauche de cette frontière.
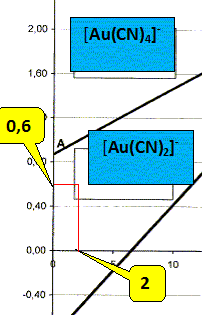
Ecrire la demi équation électronique du couple [Au(CN)2]- /Au(s). Calculer le potentiel standart de ce couple et établir la relation entre le potentiel de frontière de ce couple et pCN. On donne : constante de formation globale de [Au(CN)2]- : log b2 = 38 et le potentiel standard du couple Au+/Au(s) : E°1 = 1,68 V. Au(s) =Au+ + e- ; E1=E°1 +0,06 log [Au+]. (1) Au+ + 2 CN- = [Au(CN)2]-
Sur la frontière [ [Au(CN)2]-] = 1,0 10-3 mol/L d'où : E1= -0,60 +0,12 pCN-0,06*3 ; E1= -0,78 +0,12 pCN.
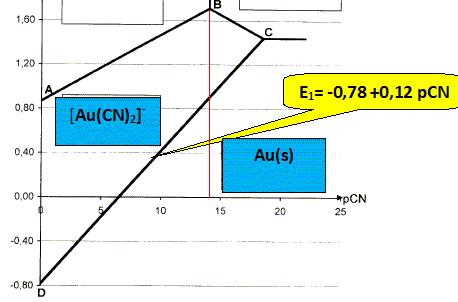
Quel phénomène est mis en évidence au point C ? Donner l'équation de la réaction correspondante. Au point C il y a équilibre entre trois espèces : Au(s), [Au(CN)2]- et [Au(CN)4]- 3 [Au(CN)2]- = 2Au(s) + [Au(CN)4]- + 2 CN- : dismutation de [Au(CN)2]- . Etablir par le calcul la pente du segment BC. On donne : potentiel standard du couple Au3+/Au+ : E°2= 1,41 V ; potentiel standard du couple Au3+/Au : E°3= 1,50 V Sur la frontière BC, il y a équilibre entre [Au(CN)2]- et Au3+. Au+ = Au3++ 2e- : E2 = E°2+ 0,03 log [Au3+] / [Au+] (2)
E2 = 1,41 +0,03*38 +0,06 log[CN-] ; E2 = 2,55 - 0,06pCN.
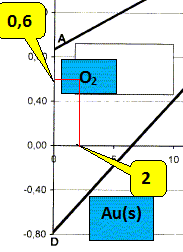
Au cours d'un traitement d'un minerai d'or, l'or métal qu'il contient est soumis à l'action d'une solution aqueuse de cyanure de sodium NaCN, de concentration 0,010 mol/L, saturée en dioxygène gazeux, et maintenue à un pH = 10,5 par addition de chaux. Cette opération porte le nom de cyanuration de l'or. Préciser pourquoi la sécurité impose de s'ssurer que le milieu est nettement basique. On donne la constante d'acidité du couple acidobasique HCN / CN- : pKa = 9,2. L'acide cyanhydrique HCN est extrêmement toxique : à pH =10, cet acide est minoritaire tandis que l'ion cyanure CN-, sa base conjuguée est majoritaire. Etablir la relation permettant de calculer le potentiel du couple O2(g) / H2O si le pH est égal à 10,5 et sous une pression de dioxygène de 1,00 bar. Donner la valeur numérique correspondante. On donne le potentiel standard du couple O2(g) / H2O : E4° = 1,23 V. ½O2(g) + 2H+(aq) + 2e- = H2O ; E4 = E4° + 0,03 log [H+(aq)]2 P½O2. E4 = 1,23 -0,06 pH. à pH=10,5, E4 = 1,23-0,06*10,5 = 0,6. Lire sur le diagramme E=f(pCN)
de l'or les espèces solubles de cet
élément pouvant être présentes
dans la solution 0,010 mol/L de cyanure de
sodium. Montrer que dans ces conditions, le dioxygène doit oxyder l'or. Ecrire l'équation de la réaction correspondante. O2 est
situé au dessus du domaine Au(s) : le
dioxygène oxyde l'or. O2 (g) /
H2O : E
= 0,6 V à pH=10,5. ½O2
+H2O + 2e- = 2HO-.
(1) [Au(CN)2]-
/Au(s) :
E1=
-0,78 +0,12 pCN =
-0,78 +0,12*2 =-0,54 V à pCN=2. 2Au(s) + 4CN-
=2[Au(CN)2]- +
2e-
(2)
(1)
+
(2)
donne : 2Au(s) +
½O2 + 4CN- +
H2O =
2[Au(CN)2]- +
2HO-.
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
|