|
Ammoniac : structure, propriétés basiques, complexes, pile Mines 2002. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
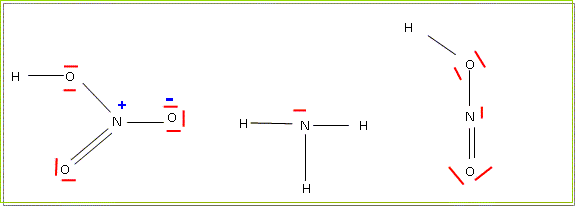
Préciser la structure électronique de l'azote (Z=7). 1s2 2s2 2p3. Ecrire les structures de Lewis de NH3, HNO2, HNO3 (l'azote est au centre) Préciser les charges formelles portées par les atomes.
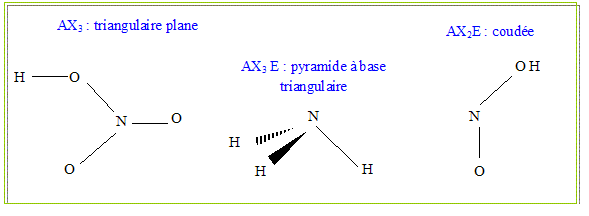
En utilisant la théorie de la V.S.E.P.R, indiquer la géométrie de NH3, HNO2, HNO3 .
Pourquoi l'analogue
n'existe-t-il pas dans la chimie de
l'azote ? L'atome de phosphore est plus volumineux que
l'atome d'azote et il possède de plus, une
couche 3d de valence : les propriètés
du phosphore sont donc assez différentes de
celle de l'azote.
Les propriétés complexantes de NH3 avec l'ion cuivre II. On définit les constantes de formation globale de complexation, bn, les constantes de loi d'action de masse pour les réactions : Cu2+ + nNH3 = Cu(NH3)n2+. Ecrire les expressions
de bn
Ecrire les expressions des constantes de dissociations successives Kdj : Cu(NH3)j2+
=Cu(NH3)j-12+ +
NH3.
[Cu(NH3)22+][NH3]
[Cu(NH3)32+][NH3]
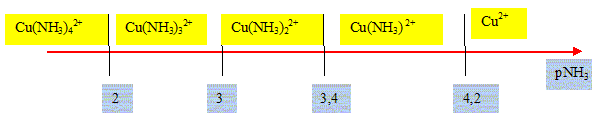
En déduire les valeurs numériques de dKdj = -logKdj. = 4,2 7,6-4,2 = 3,4 = 10,6-7,6 = 3 12,6-10,6 = 2
On considère un bécher de 50 mL contenant un mélange de 20 mL d'une solution d'ammoniaque 1 mol/L et de 20 mL d'une solution de sulfate de cuivre (II), CuSO4 , de concentration C1 = 0,01 mol.L-1. Expliquez pourquoi Cu(NH3)42+ est majoritaire. Ecrire la réaction globale. [NH3]=20*1/(20+20) = 0,5 mol/L d'où pNH3= -log 0,5 = 0,3, valeur inférieure à2. D'après le diagramme de répartition ci-dessus, Cu(NH3)42+ est majoritaire. Cu2+ + 4NH3 = Cu(NH3)42+. Quelles sont les concentrations de NH3, Cu2+ , Cu(NH3)42+ à l'équilibre.
L'ammoniac étant en large excès :xéq ~0,2 mmol ; [NH3] ~ (20-4*0,2) / 40 ~0,48 mol/L ; [Cu(NH3)42+]~ 0,2/40 ~5 10-3 mol/L.
On constitue la pile suivante à 25°C : - le compartiment A comporte une électrode de cuivre plongeant dans une solution de sulfate de cuivre II, CuSO4 , de concentration C1 = 0,01 mol.L-1 dans un bécher de 50 mL. - Le compartiment B comporte une électrode de cuivre plongeant dans un bécher de 50 mL contenant un mélange de 20 mL d'une solution d'ammoniaque de concentration C2 = 1 mol/L et de 20 mL d'une solution de sulfate de cuivre II, CuSO4 , de concentration C2 = 0,01 mol.L-1. Ecrire l'expression du potentiel de Nernst pour le couple Cu2+/Cu. En déduire la différence de potentiel UAB . E1 = E°(Cu2+/Cu) + 0,03 log [Cu2+]1 ; E2 = E°(Cu2+/Cu) + 0,03 log [Cu2+]2 ; UAB = E1-E2 = 0,03 log [Cu2+]1 /[Cu2+]2 =0,03 log (0,01 / 2,4 10-14) = 0,35 V. Faire le schéma de la pile. Préciser la borne (+) et (-). + Cu | Cu2+|| Cu(NH3)42+ | Cu - Ecrire les réactions à l'anode et à la cathode. Oxydation du cuivre de l'électrode à l'anode négative : Cu + 4 NH3 = Cu(NH3)42+ + 2e-. Réduction à la cathode positive de Cu2+ : Cu2+ + 2e- = Cu . Donner le bilan de la réaction dans le cas où on laisserait la pile débiter. Cu2+ +4 NH3 = Cu(NH3)42+. Quel est le rôle du pont salin ? Assure la continuité électrique et l'électroneutralité des solutions.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||