|
Pile et réaction de formation d'un complexe ( bac Stl biologie, génie biologique 2009) |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
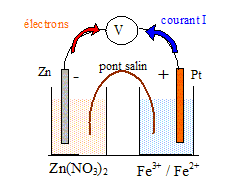
- demi-pile n° 1 : une solution contenant des ions Fe2+ à la concentration [Fe2+] =0,10 mol/L et des ions Fe3+ à la concentration [Fe3+] =0,010 mol/L dans laquelle est plongée une sonde de platine. - demi-pile n° 2 : une solution aqueuse de nitrate de zinc ( Zn2+ + 2NO3-) de volume V2 = 100 mL, telle que la concentration en ion zinc (II) soit [Zn2+ ]=0,020 mol/L, dans laquelle est plongée une lame de zinc. Etude de la demi-pile n°1. Ecrire la demi-équation du couple oxydant / réducteur concerné et donner l'expression littérale du potentiel d'électrode E1 associé. Calculer la valeur de ce potentiel. E°( Fe3+ / Fe2+ ) = 0,67 V. Fe3+ + e- = Fe2+ E1 = E°( Fe3+ / Fe2+ ) +0,06 log ([Fe3+] /[Fe2+] ) = 0,67 + 0,06 log (0,010 / 0,10) =0,61 V. Etude de la demi-pile n°2. Ecrire la demi-équation du couple oxydant / réducteur concerné et donner l'expression littérale du potentiel d'électrode E2 associé. Calculer la valeur de ce potentiel. E°( Zn2+ / Zn ) = -0,76 V. Zn2+ + 2e- = Zn E2 = E°( Zn2+ / Zn ) +0,06/2 log [Zn2+] = -0,76 + 0,03 log 0,020 = -0,81 V. Etude de la pile. Faire un schéma annoté de la pile.
E2 < E1 : le zinc constitue le pole négatif de la pile ; le platine constitue le pole positif. Les électrons circulent du zinc vers le platine dans le circuit extérieur ; le sens conventionnel du courant est de sens contraire à celui des électrons. Calculer la fem E de la pile en début de fonctionnement. E = E2-E1 = 0,61 -(-0,81) = 1,42 V. Ecrire l'équation de fonctionnement de la pile. Zn (s) = Zn2+ + 2e- 2Fe3+ + 2e- = 2Fe2+ Addition : 2Fe3+ + 2e- + Zn(s) = Zn2+ + 2e- +2Fe2+ Simplifier : 2Fe3+ + Zn(s) = Zn2+ +2Fe2+
Réaction de complexation. Dans la demi-pile n°2 on ajoute un volume V'2 = 100 mL d'une solution d'ammoniac de concentration (NH3]=0,20 mol/L. Il se forme le complexe Zn(NH3)42+. Le volume total de la solution est Vtot = 200 mL. Le potentiel d'électrode de cette demi-pile devient E'2 =-0,97 V. La concentration en ions zinc non complexés [Zn2+]éq = 1,0 10-7 mol/L. Ecriire l'équation de la réaction de formation du complexe. Zn2+(aq) + 4 NH3 (aq) = Zn(NH3)42+ (aq). Donner l'expression littérale de la constante de formation Kf ( notée aussi b) du complexe. Kf = [Zn(NH3)42+ ]éq / ([Zn2+]éq [NH3]éq4 ). Calculer les concentrations à l'équilibre [NH3]éq et [Zn(NH3)42+ ]éq en supposant totale la réaction de formation du complexe.
[NH3]éq = (0,020-4xéq ) / V'2 = (0,020-8,0 10-3) / 0,2 =0,060 mol/L. [Zn(NH3)42+ ]éq = xéq / V'2 =2,0 10-3 / 0,2 =0,010 mol/L. Calculer Kf. Kf = [Zn(NH3)42+ ]éq / ([Zn2+]éq [NH3]éq4 ). Kf = 0,01 / ( 1,0 10-7 *0,064) = 7,7 109.
|
|||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|
|