|
Préparateur en chimie : concours ITRF Val de Marne 2005.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
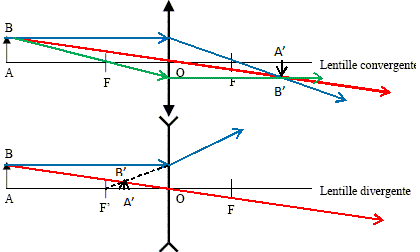
Construire l'image de l'objet AB formée par la lentille dans les deux cas suivant :
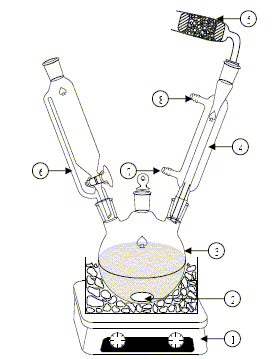
Sur un banc Köfler, plaque chauffante permettant de déterminer les points de fusion, on lit : 220 V, 50 Hz, 2 kW. - le câble d'alimentation contient trois fils : un bleu, un vert jaune, un rouge. Indiquer les couleurs conventionnelles pour - la phase : rouge ; - le neutre : bleu ; - la terre : vert jaune. Quelle est la tension mesurée ? - entre la phase et le neutre ( 220 V) ; - entre le neutre et la terre ( zéro)
P= U I ; I = P/U =
2000 / 220 = 9,1
A. Calculer la
résistance électrique de la
plaque. U= R I ; R = U/I =
220 / 9,1 =24,2 ~ 24
ohms. Quel est le montant hors taxe avant remise ? Montant hors taxe après remise : 1360 / 1,196 =1137,12 euros Montant hors taxe avant remise : 1137,12 /0,88 = 1292,19 euros. On mélange 100 mL d'une solution aqueuse de chlorure de sodium NaCl à 1,00 mol/L, 200 mL d'une solution aqueuse de chlorure de potassium KCl à 7,46 g/L et 400 mL d'une solution aqueuse de bromure de potassium KBr à 0,05 mol/L. On ajoute à ca mélange 11,2 g de chlorure de magnésium solide, totalement soluble et on ajoute de l'eau pour obtenir un volume de solution de 800 mL. Quelles sont les concentrations des ions présents dans la solution ? Mg : 24,3 ; Cl : 35,5 ; K = 39,1 g/mol M(KCl) = 39,1 + 35,5 =74,6 g/mol ; 7,46 g/L = 7,46/74,6 mol/L = 0,100 mol/L M(MgCl2) = 24,3 + 2*35,5 =95,3 g/mol ; [MgCl2] = m / M = 11,2/95,3 =0,1175 mol
On dispose d'une solution concentrée d'ammoniac. On relève sur l'étiquette ses caractéristiques : densité d = 0,892 ; composition en masse 30 % ; M(NH3) = 17 g/mol. Calculer la concentration molaire de cette solution. Masse de 1 L de solution : 0,892 kg = 892 g Masse d'ammoniac pure : 892*0,30 = 267,6 g Quantité de matière n = m / M = 267,6 / 17 = 15,74 ~ 16 mol/L. A l'aide de cette solution on souhaite préparer une solution diluée de concentration 0,050 mol/L. Quel volume faudra t-il prélever pour obtenir 250 mL de cette nouvelle solution ? Facteur de dilution noté F = concentration mère / concentration fille = 15,74 / 0,050 = 314,8 Volume à prélever = volume solution diluée / F = 250 / 314,8 = 0,794 ~ 0,79 mL. Verrerie utilisée : fiole jaugée de 250 mL et burette graduée au 1/10è de mL.
Un chimiste propose de volumes limités de deux solutions mères de KCl : - V1 = 80 mL d'une solution S1 de concentration c1 = 0,40 mol/L - V2 = 40 mL d'une solution S2 de concentration c2 = 1,20 mol/L Il a également à sa disposition des pipettes jaugées de 20 mL et des bechers de diverses capacités. Peut-il sans addition d'eau distillée préparer les solution suivantes : - 40 mL d'une solution à 0,80 mol/L ; - 60 mL d'une solution à 1,40 mol/L Si oui, quel sont les modes opératoires ? On ne pourra pas obtenir par mélanges de solutions une solution plus concentrée que la plus concentrée des solutions ( 1,40 mol/L est impossible). On mélange x mL de S1 à 40-x mL de S2 : x c1+ (40-x)c2 = 40*0,80 = 32 mmol. 0,4 x + (40-x) 1,2 = 32 ; 48-32 = 0,8 x ; x = 16/0,8 = 20 mL.
L'acide oxalique est un diacide. Il est vendu sous forme de cristaux d'acide oxalique dihydraté H2C2O4, 2H2O. C : 12 ; H : 1 ; O : 16 g/mol Une solution d'acide oxalique à 0,100 mol/L est utilisée pour doser une solution de soude NaOH ( hydroxyde de sodium) de concentration molaire inconnue. On pélève 20,0 mL de la solution de soude et on observe l'équivalence pour un volume versé de 12,5 mL de solution d'acide oxalique. Ecrire l'équation de la réaction de dosage et calculer la concentration molaire de la solution de soude. H2C2O4 + 2 HO- = C2O42- + 2H2O. A l'équivalence les quantités de matière d'acide oxalique et de soude sont en proportions stoechiométriques : n(soude) = 2 n(acide) n(acide) = 12,5 10-3 * 0,100 = 1,25 10-3 mol ; n( soude) = 2*1,25 10-3 = 2,50 10-3 mol Concentration de la soude : quantité de matière (mol) / volume (L) = 2,50 10-3 / 20,0 10-3 = 0,125 mol/L.
Donner les symboles des éléments :
L'isomérie de chaîne désigne les isomères qui diffèrent par leur squelette carboné. CH2=CH-CH2-CH2-CH3, pent-1-ène. L'isomérie de position de fonction : la double liaison est placée à un autre endroit de la chaîne carbonée. CH3-CH=C(CH3)2 , 2-méthylbut-2-ène. La propulsion des fusées est assurée par des moteurs utilisant l'énergie libérée par la réaction entre l'hydrazine N2H4 et le tétraoxyde de diazote N2O4. Cette réaction produit du diazote N2 et de l'eau à l'état gazeux à la température de 150 °C. Ecrire l'équation bilan de cette réaction. 2 N2H4(g) + N2O4(g) --> 3 N2(g) +4 H2O(g). Quelle est la masse de tétraoxyde de diazote nécessaire pour réagir avec 320 kg d'hydrazine ? N : 14 ; H : 1 ; O : 16 g/mol. M(N2H4) = 2*14+4 = 32 g/mol ; n(N2H4) = m/M = 320 000 / 32 = 104 mol. n(N2O4) = ½ n(N2H4) = 5000 mol M(N2O4) = 2*14+4*16 = 92 g/mol ; m(N2O4) = 5000*92 = 4,6 105 g = 4,6 102 kg. Quel volume de gaz obtient-on ( Vm= 35 L/mol dans les conditions de l'expérience) n(N2) = 3 n(N2O4) ; n(H2O) = 4 n(N2O4) ; n total = 7 n(N2O4) = 7*5000 = 35 000 mol de gaz Volume de gaz : n total Vm=35000*35 = 1,23 106 L = 1,23 103 m3.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
c |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||