|
Les atomes : structure nucléaire et électronique; scintigraphie d'après DTS IMRT 00 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
Masse d'un proton : mp = 1,007276 u ; masse d'un neutron : mn = 1,008665 u Masse d'un noyau de cobalt 59 : mCo = 58,918388 u ; unité de masse atomique : 1 u = 931,5 MeV / c2 Le noyau d'un atome de cobalt est représenté par 5927Co. Donner la constitution de ce noyau. Combien y a-t-il d'électrons dans l'atome ? 27 protons ; 59-27 = 32 neutrons ; 27 électrons. Exprimer et calculer le défaut de masse du noyau de cobalt en unité de masse atomique. Dm = mCo-27mp -32 mn =58,918388 -27*1,007276 -32*1,008665= -0,555344 u. Définir l'énergie de liaison d'un noyau. La calculer en MeV pour le noyau de cobalt. En déduire l'énergie de liaison par nucléon. On appelle énergie de liaison notée El d'un noyau l'énergie que doit fournir le milieu extérieur pour séparer ce noyau au repos en ses nucléons libres au repos. 1 u = 931,5 MeV / c2 ; Dm =0,555344*931,5 =517,3 MeV / c2. El = 517,3 MeV Energie de liaison par nucléon : 517,3 / 59 = 8,78 MeV/nucléon. L'électron est caracterise par 4 nombres quantiques. - n, nombre quantique principal - l, nombre quantique secondaire (0 <= l <= n-1 ) - m, nombre quantique magnetique (-l <= m <= l ) - s, nombre quantique de spin ( s = +1/2 ou -1/2) Donner la configuration électronique de plus basse énergie des atomes suivants : 11Na ; 27Co ; 15 P. Les situer (ligne et colonne) dans la classification périodique à 18 colonnes. 11Na : 1s2 2s2 2p6 3s2 3p1. 3è période ; colonne n°1. 27Co : 1s2 2s2 2p6 3s2 3p6 4s2 3d7. 4è période ; colonne n°9. 15 P : 1s2 2s2 2p6 3s2 3p3. 3è période ; colonne n°15. Quel est le nombre
maximum d'électrons sur chacune de ces
couches
? K : n=1; deux
électrons au maximum ; L : n=2; huit
électrons au maximum ; M : n=3 ; 18
électrons au maximum ; N : n=4 : 32
électrons au maximum. Pour chacun des atomes
précédents, indiquer combien il y a
d'électrons sur chacune de ces
couches. 11Na : K(2)
L(8) M(3) ; 27Co :
K(2) L(8) M(15)
N(2) ; 15 P :K(2)
L(8) M(5) ; A quelle valeur du
nombre quantique 1 correspondent les sous couches
s, p, d, f ? s : l=0 ; p : l=1 ; d : l=2 ; f : l=3. Quel est le nombre
maximum d'électrons sur chacune de ces
sous-couches ? s : 2électrons au plus ; p : 6
électrons au plus ; d : 10 électrons
au plus ; f : 14 électrons au plus. Quelle est la
dernière sous couche occupée par des
électrons pour les lanthanides et les
actinides qui sont écrits sur deux lignes
séparées en bas de la
classification ? sous couche s. Scintigraphie : La plupart des questions peuvent être traitées indépendamment les unes des autres. Données : masse d'un deuton md = 2,014 102 u ; masse d'un neutron mn = 1,008 665 u Masse d'un électron me = 0,000 548 u ; masse d'un atome de tellure 122 MTe = 121,903 047 u Masse d'un atome d'iode 123 MI = 122,905 598 u On négligera l'énergie de liaison des électrons Charge élémentaire e = 1,602 ·10-19 C ; célérité de la lumière dans le vide c = 3,0.108 m.s-1 Constante de Planck h = 6,626 ·10-34 J.s ; unité d'activité 1 Ci = 3,7 ·1010 Bq Extraits de la classification périodique : 51Sb ( antimoine) ; 52Te (tellure) ; 53I ( iode) ; 54Xe( xénon) ; 55Cs ( césium) 6C ; 7N ; 8O ; 9F ; 10Ne. L'imagerie scintigraphique utilise des traceurs et des marqueurs. Un traceur est une substance qui peut se localiser de façon sélective au niveau d'une structure particulière de l'organisme. Un marqueur est un nucléide radioactif qui se prête aisément à une détection externe. L'association d'un traceur et d'un marqueur permet, grâce au marqueur, de suivre l'évolution du traceur dans l'organisme. Les différentes familles de marqueurs : Le marqueur doit émettre des photons g afin de pouvoir être détecté à l'extérieur de l'organisme à l'aide d'une gamma-caméra. Trois familles de marqueurs sont utilisées : Les émetteurs (ß-,g ) : l'iode 131 appartient à cette catégorie.
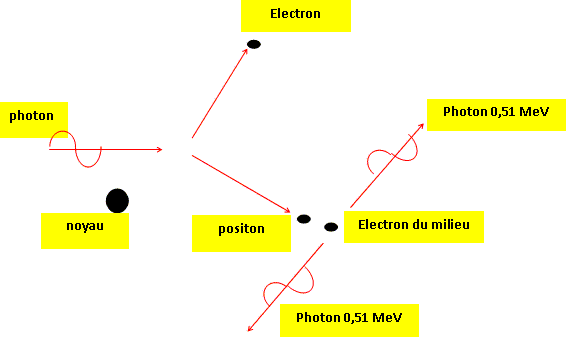
Écrire l'équation de sa désintégration : 13153I ---> 13154Xe +0-1e Expliquer l'origine du rayonnement g qui accompagne la désintégration ß-. Le noyau fils se désexite ( libère de l'énergie en revenant à un état de moindre énergie) en émettant un photon g. Les émetteurs ß+ : l'oxygène 15 appartient à cette catégorie. Écrire l'équation de sa désintégration : 158O ---> 157N +0+1e Que devient le positon émis au cours d'une désintégration ß+ ? En déduire l'origine des photons g. Le chemin suivi par le positon est très court, il est freiné par la matière et s'annihile en fin de course avec un électron du milieu.
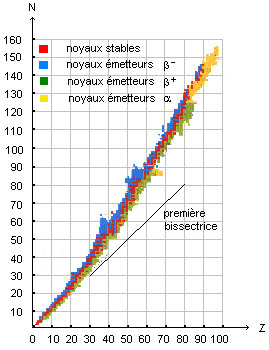
Les émetteurs g purs par capture électronique . Le technétium 99 métastable appartient à cette catégorie. D'où provient l'électron capturé par le noyau de technétium ? Un noyau atomique capture un électron situé sur une couche électronique interne de l'atome. Un proton se transforme alors en neutron : 11p + 0-1 e = 10n + neutrino. Pourquoi dit-on qu'il s'agit d'une transformation isobarique ? Le nombre de masse A, nombre de nucléons est inchangé. Donner l'allure de la courbe de stabilité qui représente le nombre de neutrons N (en ordonnée) en fonction du numéro atomique Z (en abscisse). Situer sur cette courbe les zones de radioactivité ß+.
Comment sont situés les isotopes d'un même élément ? Deux isotopes ont le même numéro atomique Z ; ils ne différent que par le nombre de neutrons : ils sont situés sur la même verticale d'abscisse Z. Les nucléides qui peuvent subir la capture électronique et la désintégration ß+ sont-ils toujours au dessous de la droite N = Z ? Justifier en envisageant le cas des nucléides légers et celui des nucléides lourds. capture électronique : 11p + 0-1 e = 10n + neutrino ; Z diminue de 1 et N augmente de 1. radiactivité ß+ : 11p = 10n + 0+1 e ; Z diminue de 1 et N augmente de 1. D'après le graphe ci-dessus, les noyaux lourds conduisant à ce type de désintégration se trouvent au dessus de la première bissectrice ( droite N=Z). Ce même graphe indique que certains noyaux légers conduisant à ce type de désintégration se trouvent au dessous de la première bissectrice.
L'iode 123 est un émetteur g pur. Sa période est de 13,2 heures. Calculer sa constante radioactive l en s-1. lt½ = ln2 avec t½ = 13,2*3600 =4,75 104 s. l = ln2 / 4,75 104 =1,46 10-5 s-1. Pour une scintigraphie thyroïdienne, il faut injecter à un patient adulte une quantité d'iode 123 d'activité égale à 7,4 MBq. Combien d'atomes d'iode a-t-on injectés ? A = l N ; N = A / l =7,4 106 / 1,46 10-5=5,1 1011 atomes. Le délai entre l'administration du traceur et la réalisation des images est de 2 à 4 heures. Quel est le pourcentage de perte d'activité en 4 heures ? Loi de décroissance radioactive : A = A0 exp (-lt) avec l t½ = ln2 et t=4 heures. exp (-lt) = exp(-ln2 t / t½) ; A / A0 =exp(-ln2 t / t½) = exp(-ln2*4/13,2)=0,81. (pertes 0,19 ou 19 %).
|
||||||
|
|
||||||
|
|