|
|
||||||||||||||||
|
||||||||||||||||
|
Soient les complexes suivants [Hg(NH3)2]2+ et [Hg(NH3)3]2+ caractérisés par leurs constantes de formation respectives b2= 1018 et b3 = 1020.
Données: NH4+ / NH3 : pKa= 9,2. corrigé |
||||||||||||||||
|
[Hg(NH3)3]2+ : ion triamminemercure III écrire les deux réactions de complexations : Hg2+ + 2NH3 équilibre avec [Hg(NH3)2]2+ ; b2 = 1018 Hg2+ + 2NH3 équilibre avec [Hg(NH3)2]2+ ; b3 = 1020 le complexe est d'autant plus stable que sa constante de formation est grande ; la seconde réaction est prépondérente et quasi-quantitative
L'ammoniac est une base faible peu dissociée sous cette concentration : [NH4+] voisin de zéro. conservation de l'élément mercure : 0,01 = [Hg2+] + [[Hg(NH3)2]2+] +[ [Hg(NH3)3]2+] (1) constante de formation des complexes :
dans (1) mettre [Hg2+] en facteur commun
remplacer [NH3] par 0,97 et b2 par 1018 et b3 par 1020. 0,01 = [Hg2+] ( 1 + 9,4 1017 +9,1 1019 ) d'où [Hg2+] = 1,08 10-22 mol/L à partir de l'expression de b2 : [[Hg(NH3)2]2+]=1018*1,08 10-22*0,97² = 1,02 10-4 mol/L à partir de l'expression de b3
:
[[Hg(NH3)3]2+]=1020*1,08
10-22*0,973 =
9,90
10-3 mol/L
pH d'une solution d'acide ou de base faible : pH = pKa + log [NH3]/[NH4+] d'où : [NH3]/[NH4+] = 7,2-9,2 = 0,01 [NH3] = 0,01 [NH4+].(3) conservation de l'élément azote : 1 = [NH3] + [NH4+] + 2 [[Hg(NH3)2]2+] + 3[ [Hg(NH3)3]2+] (2) or [Hg2+]initial =0,01 mol/L [[Hg(NH3)2]2+] et [ [Hg(NH3)3]2+] sont au plus égaux à 0,01 mol/L (2) s'écrit : 1 voisin de [NH3] + [NH4+] compte tenu de (3) : [NH4+] voisin 1 mol/L ; [NH3] voisin 0,01 mol/L. faire le rapport : b3 /b2 :
[[Hg(NH3)2]2+] = [ [Hg(NH3)3]2+] conservation de l'élément mercure : voir ci dessus
remplacer [NH3] par 0,01 et b2 par 1018 et b3 par 1020. 0,01 = [Hg2+] ( 1 +1014 + 1014 ) d'où [Hg2+] = 5 10-17 mol/L à partir de l'expression de b2 : [[Hg(NH3)2]2+]=1018*5 10-17*10-4 = 5 10-3 mol/L
|
||||||||||||||||
|
Compétition entre ligands : Soit 1 L de solution (S) contenant : 10-3 mol d'ion Fe3+ ; 0,1 mol d'ion thiocyanate SCN- ; 0,1 mol d'ion fluorure F-. données : constante de formation des ions complexes [Fe(SCN)]2+ : Kf1 = 103 ; [Fe(F)]2+ : Kf2 = 103 ; pKa du couple HF/ F- : 3,2 ;
corrigé [Fe(SCN)]2+ : ion thiocyanatofer III [Fe(F)]2+ : ion fluorofer III équation de formation des ions complexes : Fe3+ + SCN- équilibre avec
[Fe(SCN)]2+ ; Kf1 =
103 = Fe3+ + F- équilibre avec
[Fe(F)]2+ ; Kf2 =
106= le complexe est d'autant plus stable que sa constante de formation est grande ; L'ajout d'ion fluorure F- à une solution contenant l'ion complexe [Fe(SCN)]2+ provoque sa disparition: [Fe(SCN)]2+ + F- équilibre avec [Fe(F)]2+ + SCN- dont la constante d'équilibre est :
cas limite d'une réaction quasi-quantitative.
abaissement du pH : les équilibres suivants existent en solution : (a) Fe3+ +
SCN- équilibre avec
[Fe(SCN)]2+ ; Kf1 =
103 = (b) Fe3+ +
F- équilibre avec
[Fe(F)]2+ ; Kf2 =
106= (c) HF + H2O en
équilibre avec F- +
H3O+ ; Ka = l'apport d'ion oxonium H3O+ provoque le déplacement de (c) vers la gauche (loi de modération) et la disparition d'une partie des ions fluorures. Ces ions F- sont partiellement régénérés par la rupture de l'équilibre (b) ( déplacement vers la gauche et formation dion fer III.. Ces ion Fe3+ sont alors consommés en (a) conduisant à la formation du complexe [Fe(SCN)]2+ et à l'apparition d'une coloration rouge. écrire les équations de conservation : [Fe3+] + [[Fe(SCN)]2+]+[[Fe(F)]2+]= 10-3 (1) [F-]+[HF]+[[Fe(F)]2+ ]= 0,1 (2) [SCN- ]+[[Fe(SCN)]2+] = 0,1 (3) la teinte rouge apparaît lorsque [[Fe(SCN)]2+] = 3,16 10-6 mol/L d'où (3) donne : [SCN-
]
voisin
0,1 mol/L [Fe3+]
=3,16
10-8 mol/L [[Fe(F)]2+
]
=10-3
mol/L [F-]
=3,16
10-2
mol/L [HF]
=6,74
10-2
mol/L pH fin = pKa + log [F-] / [HF] = 3,2 + log 3,16 / 6,74 = 2,87. |
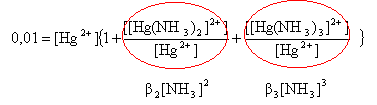
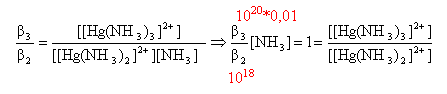
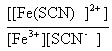
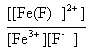

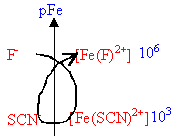
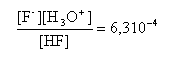 (4)
(4)