|
concours kiné Berck/ mer 2002
|
||||||||||||||||
|
On étudie en fonction du temps l'évolution d'un mélange de 100 mL de solution d'acide oxalique de concentration C1 =0,08 mol/L et de 100 mL de dichromate de potassium de concentration C2=0,02 mol/L. Les couples d'oxydo-réduction intervenant dans cette réaction sont : Cr2O72- / Cr3+ ; CO2 / H2C2O4.
corrigé
Cr2O72- + 6e- + 14H+ --> 2Cr3+ + 7H2O 3 fois {H2C2O4 -> 2CO2 +2e- +2 H+} Cr2O72- + 14H+ + 3 H2C2O4--> 2Cr3+ + 6CO2 +6 H+ + 7H2O Cr2O72- + 8H+ + 3 H2C2O4--> 2Cr3+ + 6CO2 + 7H2O Cr2O72- + 8H3O+ + 3 H2C2O4--> 2Cr3+ + 6CO2 + 15H2O
8-3x =0 donne x = 8/3 = 2,66 mmol donc xmax = 2 mmol l'oxydant est en
défaut.
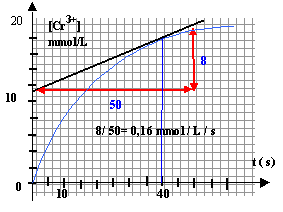
coeff directeur de la tangente à la courbe à t = 40 s.
0,16 mmol /L /s = 1,6
10-4 mol/L/ s.
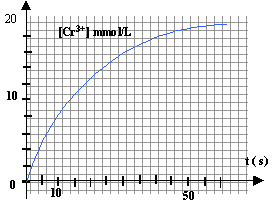
Le tableau ci-dessus donne 4 mmol d'ion Cr3+ contenu dans 0,2 L de solution. [Cr3+] = 4 10-3
/ 0,2 = 2 10-2 mol/L =
20
mmol/L.
au temps de demi réaction noté t½ la moitié du réactif limitant a disparu : il s'est donc formé 10 mmol d'ion Cr3+. lire sur le graphe l'abscisse correspondante à [Cr3+] = 10 mmol/L t½ voisin de 12 s.
retour - menu |