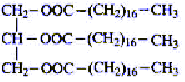|
|
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
On étudie la cinétique de la réaction d'une solution aqueuse de peroxodisulfate de potassium K2S2O8 sur une solution d'iodure de potassium KI. A la date t=0, on mélange 500 mL d'une solution aqueuse de peroxodisulfate de potassium de concentration molaire C1=0,015 mol/L avec 500 mL d'une solution de KI de concentration C2. A différentes dates on effectue des prélevements que l'on refroidit dans la glace fondante. On dose ensuite le diiode formé. 21/25 = 0,84 ; couple redox : S2O82- / SO42- et I2/ I-. 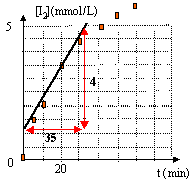
corrigé S2O82- + 2e- -->2SO42- réduction 2I- --> I2 + 2e- oxydation
1 est faux : Qté de matière S2O82- : 0,015*0,5 = 7,5 10-3 mol. si les conditions sont stoéchiométriques alors il faut 2*7,5 10-3 mol= 1,5 10-2 mol KI C2 = 1,5 10-2 / 0,5 = 0,03 mol/L 2 est vrai : trempe ou blocage cinétique 3 est faux : à t = 25s le coefficient directeur de la tangente à la courbe vaut :d[I2]/dt = 4 10-3 / 35 = 1,14 10-4 mol L-1 min-1. la valeur est proche de 8,4 mmol L-1 min-1. 4 est vrai :
|
||||||||||||||||||||||||||||||||
|
On étudie la cinétique de la réaction entre l'ion permanganate MnO4- et l'acide oxalique H2C2O4. On observe un dégagement de CO2. 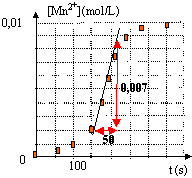
corrigé 2 fois MnO4- +8H++ 5e- -->Mn2+ + 4H2O réduction 5 fois H2C2O4 -->2CO2 +2H+ + 2e- oxydation
1 est faux : milieu acide 2 est vrai et 3 faux : tangente à la courbe à t <50 s presque horizontale : vitesse faible car l'un des produits Mn2+ est le catalyseur en quantité peu importante. à t >200 , tangente à nouveau presque horizontale car les réactifs ont pratiquement disparu. dans la partie centrale, la tangente à la courbe se rapproche de la verticale : vitesse élevée , catalyseur et réactifs en grande quantité. 4 est faux : chercher le coefficient directeur de la tangente à la courbe à t = 150 s. v = d[Mn2+]/dt voisin de0,007/50 = 1,4 10-4 mol L-1 s-1. |
||||||||||||||||||||||||||||||||
|
Le peroxyde d'hydrogène appelé couramment eau oxygénée est un antiseptique. Au cours du temps, la teneur en H2O2 d'un flacon d'eau oxygénée diminue car les molécules se transforment lentement en eau et dioxygène. H2O2 --> ½O2 + H2O.
corrigé 1 est vrai : H2O2 +2H++2e- -->2H2O réduction H2O2 --> O2 + 2H++2e- oxydation 2H2O2 --> O2 +2H2O H2O2 joue à la fois le rôle d'oxydant et de réducteur. 2 est faux : (0,56-0,53)/ 12 = 0,03/12 = 2,5 10-3 mol mois-1. 3 et 4 sont vrais : il disparaît 2,5 10-3 mol H2O2 par mois et il se forme ½ *2,5 10-3 mol = 1,25 10-3 mol O2 par mois soit 24*1,25 10-3 = 0,03L = 30 mL. catalyse hétérogène par le platine.
|
||||||||||||||||||||||||||||||||
|
On dispose d'hydroxyde de sodium en pastilles. Chaque pastille a une masse de 0,1 g. On souhaite réaliser 1 litre d'une solution d'hydroxyde de sodium S0 de concentration C0= 0,1 mol/L. ( Na = 23 ; O= 16 ; H= 1 g/mol)
corrigé 1 est vrai : masse molaire NaOH : 23+1+16 = 40 g/mol S0 contient 0,1 mol/L soit 4g soit 40 pastilles. 2 est faux : pH=12 alors [H3O+]=10-12 et à 25° [HO-]=0,01 mol/L facteur de dilution : 0,1 / 0,01 = 10. il faut prélever 100 mL de S0 (burette ou pipette) et compléter avec 900 mL d'eau distillée dans une fiole jaugée de 1L. 3 et 4 sont
vrais
:
|
||||||||||||||||||||||||||||||||
|
On dispose de trois solutions d'acide chlorhydrique notées S1, S2, S3 et de trois indicateurs colorés.
pKe = 14 ; log 3,2 = 0,5 ; 1/3,2 = 0,32. corrigé 1, 2 et 3 sont vrais : S2 : le bleu de bromocrésol est jaune , donc pH<3,8 le rouge de métacrésol est jaune donc pH>2,8 l'hélianthine est orange donc 3,1< pH<4,4. 4 est faux : pH=1,5 alors [H3O+]=10-1,5 soit log [H3O+] = -1,5 et à 25° log [HO-]+ log [H3O+] =-14 log [HO-] = -14 +1,5 = -12,5 = -13+0,5 log [HO-] =log 10-13 + log 3,2 = log(3,2 10-13) [HO-] =3,2 10-13
|
||||||||||||||||||||||||||||||||
|
On dose un volume V= 30 mL d'une solution aqueuse d'acide méthanoïque HCOOH de concentration Ca, puis un volume V' = 20 mL d'une solution d'acide chlorhydrique de concentration Ca' = 0,1 mol/L par une solution d'hydroxyde de sodium de concentration Cb. Au cours du dosage on suit l'évolution du pH du milieu en fonction du volume Vb de solution de soude versée. 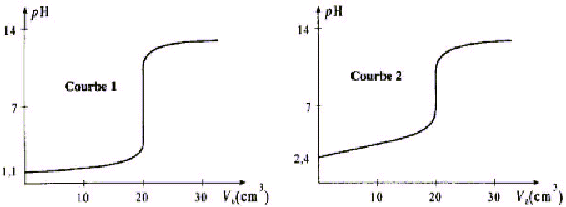
corrigé 1 est faux : courbe 1 : le pH à l'équivalence vaut 7 , donc dosage HCl par NaOH 2 est vrai : à l'équivalence (courbe 1): C'a V'a = CbVb Cb = 0,1*20/20 = 0,1 mol/L 3 est faux : à l'équivalence (courbe 2): Ca Va = CbVb Ca = 0,1*20/30 = 0,067 mol/L 4 est faux : à la demi-équivalence (courbe 2) pH=pKa proche de 4. |
||||||||||||||||||||||||||||||||
|
Le lactose contenu dans le lait se transforme en acide lactique CH3-CHOH-COOH en présence de bactéries. Un degré Dornic ou °D représente 0,1 g d'acide lactique par litre de lait. Pour être consommable l'acidité ne doit pas dépasser 18°D. On effectue lke dosage de 20 mL de lait par une solution
d'hydroxyde de sodium de concentration 0,05 mol/L. Un
logiciel permet d'obtenir les graphes ci-dessous : - pourcentage des espèces chimiques du couple acide lactique (noté AH) et de sa base conjuguée (noté A-) en fonction du volume de soude versé. 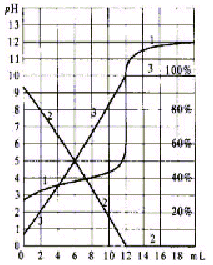
corrigé 1 est faux : au début du dosage : lait dans le becher et soude dans la burette donc le pH dans le becher étant proche de 3 ( lecture graphe 1), la forme acide AH prédomine ( le pKa du couple étant voisin de 5) et en conséquence la courbe 2 correspond au pourcentage de AH. autre raison : au cours du dosage AH diminue at la base conjuguée A- croît. 2 est vrai : à l'équivalence (courbe 1): Ca Va = CbVb Ca = 0,05*12/20 = 0,03 mol/L 3 est faux : masse molaire acide lactique : 90 g/mol soit 0,03*90 = 2,7 g d'acide lactique dans 1 L ou 27 °D. valeur supérieure à 18°D, le lait n'est pas frais. 4 est vrai :
|
||||||||||||||||||||||||||||||||
|
On dissout 210 mg de fluorure de sodium solide NaF dans l'eau distillée de façon à obtenir 100 mL de solution. Le pH de la solution ainsi obtenue est 7,9.
corrigé 1 est faux : masse molaire NaF = 23+19 = 42g/mol 0,21/42 = 5 10-3 mol dans 0,1 L donc [Na+]= 0,005/0,1 = 0,05 mol/L 2 est faux : l'ion Na+ n'est ni une base, ni un acide ; il reste indifférent dans l'eau l'ion F- est la base conjuguée de l'acide HF. 3 est vrai : si F- est une base forte alors pH=14 + log (0,05) = 12,7. Or la valeur mesurée est inférieure à 12,7 : donc F- est une base faible. 4 est vrai : à concentration égale, la base la plus forte appartient au couple ayant le plus grand pKa et sa solution a le plusgrand pH. NH3 : pH=10,9 et F- : pH=7,9 donc pKa(HF/F-) <9,2. |
||||||||||||||||||||||||||||||||
|
L'étiquette d'un vinaigre de cidre porte l'indication : 5°. On rappelle que le degré d'un vinaigre est la masse d'acide éthanoïque H3C-COOH pur contenue dans 100 g de vinaigre. rvinaigre = 1000 kg/m3. Masse molaire acide éthanoïque = 60 g/mol. On dilue ce vinaigre au dixième, on prélève 25 mL de la solution obtenue auxquels on ajoute quelques gouttes de phénolphtaléine et on titre ce prélevement avec de la soude à 0,2 mol/L. Le virage de l'indicateur coloré a lieu pour un volume de base égal à Vb= 10,4 mL.
corrigé 1 est vrai : à l'équivalence du dosage : CaVa = CbVb soit Ca = 0,2*10,4/25 = 0,083 mol/L en tenant compte de la dilution du vinaigre ; Cvinaigre = 0,83 mol/L masse molaire de l'acide éthanoïque : CH3COOH : 60 g/mol masse de vinaigre pur dans 1 L : 60*0,83 = 49,8 g ou 4,98 g dans 100 mL ou 100g de vinaigre ( 5°) 2 est faux : fiole jaugée et pipette + pipeteur sont nécessaires à une dilution. 3 est faux : l'acide (vinaigre) est dans le bécher et la soude dans la burette : la couleur de la solution dans le becher vire de l'incolore au rose. 4 est faux : à l'équivalence, solution d'éthanoate de sodium : présence d'une base, l'ion éthanoate, donc le pH de la solution est supérieur à 7.
|
||||||||||||||||||||||||||||||||
|
Le pH du sang artériel est de 7,4. Comme ma plupart des milieux biologiques le pH du sang est régulé par des couples acide/base. Les principaux couples intervenant dans le sang sont : CO2 (aq) / HCO3- pKa1 = 6,3 à 37°C et H2PO4- / HPO42- pKa2 = 6,8 à 37°C. à 37°C pKe = 13,72 ; [H2PO4-]=5 10-4 mol/L ; log 2 = 0,3 et log 5 = 0,7.
corrigé 1 est vrai : pH du milieu neutre = ½pKe = 0,5*13,72 = 6,86 à 37°. le pH du sang étant supérieur à 6,86 , le milieu est basique. 2 est vrai : HCO3- : base du couple CO2 (aq) / HCO3- HCO3- : acide du couple HCO3- /CO32- HCO3-est amphotère : il peut jouer le rôle d'acide ou celui de base. 3 est faux : le pH du sang est supérieur au pKa du couple H2PO4- / HPO42- donc l'espèce HPO42- prédomine. 4 est vrai : pH = pKa2 + log [ HPO42-] /[H2PO4-] log [ HPO42-] /[H2PO4-] = 7,4-6,8=0,6 [ HPO42-] /[H2PO4-] = 4 [ HPO42-] =4*[H2PO4-] = 4*5 10-4 = 2 10-3 mol/L.
|
||||||||||||||||||||||||||||||||
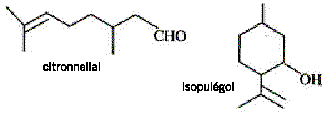 citronnellal et isopulégol : M=154 g/mol ; 1000 / 154 = 6,5 ; 1000 / 0,85 = 1180 ; 154*0,85 = 131 ; 1180 / 154 = 7,6.
corrigé 1 est faux : le citronnellal ne compte pas de fonction alcool ( groupe -OH fixé sur un carbone tétragonal) mais uns fonction aldehyde -CHO 2 est faux : pas de possibilité d'isomérie Z/E : l'un des carbones de la liaison double >C=C< compte deux groupes identiques ( les groupes méthyle CH3-) 3 est vrai : l'atome de carbone n°3 porte 4 substituants ou groupes différents : il est asymétrique. 4 est vrai : 106 / 154 = 6493,5 mol isopulégol donc en tenant compte du rendement 6493,5 / 0,85 = 7639,4 mol citronnellal. |
||||||||||||||||||||||||||||||||
|
Par réaction entre l'acide gallique A et le propan-1-ol on obtient le gallate de propyle B qui est un antioxydant. 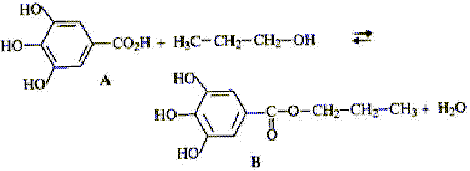 masse molaire A = 170 g/mol ; masse molaire B= 212 g/mol ;
corrigé 1 est vrai : estérification lente, athermique, limitée par l'hydrolyse de l'ester. 2 est faux : l'anhydride d'acide doit dériver de l'acide carboxylique. 3 est vrai : propan-2-ol CH3-CHOH-CH3 et CH3-O-CH2-CH3 4 est vrai : 1,7 / 170 = 0,01 mol d'acide gallique donc théoriquement 0,01 mol d'ester, soit 212 *0,01 = 2,12 g ester. rendement = masse réelle / masse théorique * 100 = 1,27/2,12*100 = 60%.
|
||||||||||||||||||||||||||||||||
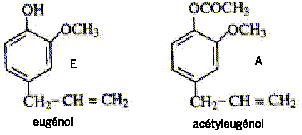
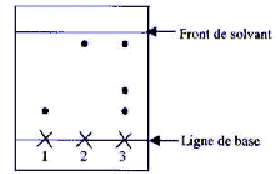
corrigé 1, 2 sont vrais : 3 est faux : rapport frontal Rf = distance pacourue par l'eugénol / distance parcourue par le solvant en mesurant ces distances sur le chromatogramme on trouve Rf (eugénol) voisin de 0,15. 4 est vrai : masse eugénol dan les clous de girofle : 40*0,15 = 6 g eugénol rendement : 100* masse réelle / masse théorique = 100-2 /6 = 33,3%. |
||||||||||||||||||||||||||||||||
|
Dans un ballon équipé d'un agitateur magnétique et d'un réfrigérant ascendant on introduit : - 89 g de lard, que l'on considérera comme
étant le tristéarate de glycéryle
- 100 mL d'éthanol et de la soude en excès. On chauffe à reflux pendant 20 minutes. On laisse refroidir puis on ajoute le contenu du ballon dans 250 mL d'une solution saturée de chlorure de sodium. On filtre sous vide sur un filtre Büchner et on rince le solide obtenu à l'eau froide. On pèse enfin le solide, après séchage. Sa masse est 73,5 g.
corrigé 1 est faux : l'éthanol est le solvant dans le quel le lard et la soude sont solubles. 2 est faux : l'espèce chimique obtenue est le savon CH3-(CH2)16-COONa : masse molaire : 12*18+35+2*16+23 = 306 g/mol. 3 est faux : le savon est insoluble dans l'eau saturée de chlorure de sodium: le savon précipite. 4 est vrai : masse molaire du lard : C57H110O6 : 57*12+110+6*16 = 890 g/mol saponification du lard : lard + 3 (NaOH) --> 3 CH3-(CH2)16-COONa + glycérol Qté de matière de lard : 89/890 = 0,1 mol donc on attend 0,3 mol de savon soit 306*0,3 = 91,8 g rendement 73,5 / 91,8*100 = 80% |
||||||||||||||||||||||||||||||||
|
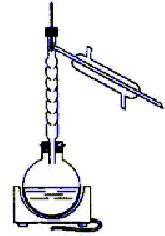
On synthétyse le méthanoate d'éthyle par une réaction d'estérification en milieu sulfurique entre l'acide méthanoïque HCOOH et l'alcool éthylique C2H5OH. On introduit dans le mélange réactionnel 23 mL d'acide méthanoïque, 23 mL d'éthanol, 5 mL d'acide sulfurique concentré et quelques grains de pierre ponce. En fin de réaction on récupère 32 mL d'ester.
corrigé 1 est faux : HCOOH : masse molaire 46 g/mol masse : 23*1,2= 27,6 g ; Qté de matière : 27,6/46 = 0,6 mol éthanol C2H6O : masse molaire 46g/mol masse 23*0,8 = 18,4 g ; Qté de matière 18,4/46 = 0,4 mol HCOOH + éthanol = méthanoate d'éthyle + eau la réaction s'effectue mole à mole : donc éthanol en défaut. 2, 3, 4 sont vrais : montage de distillation et l'ester étant le constituant le plus volatil, il distille en premier. L'élévation de la température est un facteur cinétique favorable : la vitesse de la réaction augmente. loi de Le Chatelier : en éliminant l'ester par distillation au fur et à mesure qu'il se forme, on déplace l'équilibre vers la droite : formation de l'ester. Le rendement sera proche de 100%.
|
||||||||||||||||||||||||||||||||
|
On souhaite doser l'aspirine commerciale. Pour cela on dissout un comprimé dans 50 mL d'eau. On complète à 100 mL avec de l'eau pure et on dose 10 mL de la solution ainsi obtenue avec de l'hydroxyde de sodium à 0,01 mol/L 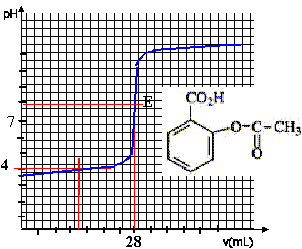 masse molaire de l'aspirine M=180 g/mol.
corrigé 1 est vrai : 2 est faux : le pH à la demi-équivalence est égal au pKa du couple acide base : sur le graphe on lit pour V=13 mL pHvoisin de 3,5. 3, 4 sont vrais : La réaction acide base est rapide à chaud comme à froid. à l'équivalence CaVa = CbVb avec Vb= 26 mL (lecture graphe) Ca = 0,01*26/10 = 0,026 mol/L facteur de dilution : 100 / 50 = 2 donc Caspirine = 0,052 mol/L soit 0,052*0,05 = 2,6 10-3 mol aspirine dans 50 mL, dans un comprimé. masse molaire aspirine : 180 g/mol 180 * 2,6 10-3 = 0,468 g ou 468 mg (proche de 500 mg) retour - menu |