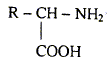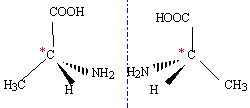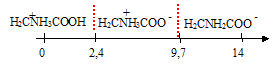|
CAPES
physique chimie (
d'après
concours interne 2002 ) acide a-aminé : nomenclature (RS) et (DL) ; acide base En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|
| .
. |
|
|
|
|
On rappelle la formule semi-développée d'un
acide a-aminé. Les différentes fonctions chimiques présentes dans la molécule d'un acide a-aminé : -COOH : acide carboxylique ; -NH2 : amine alanine ou acide 2-aminopropanoïque :
le carbone asymétrique ( carbone tétragonal lié à 4 groupes différents ) est responsable de l'isomérie optique. les deux énantiomères ne sont pas superposables à leur image dans un miroir ( molécule chirale)
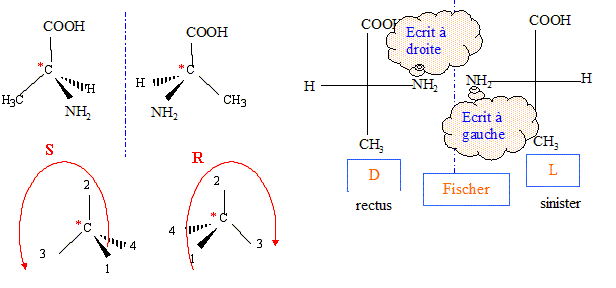
numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. NH2 (1) ; COOH (2) ; CH3 (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou anti-horaire), le carbone est Sinister (S). Lévogyre : qui a la propriété de faire dévier le plan de polarisation de la lumière polarisée dans le sens inverse des aiguilles d’une montre. (vers la gauche) Il n'existe pas de relation générale entre les configurations D et L d'une molécule et le signe (+) ou (-) de son pouvoir rotatoire. L'alanine naturelle appartient à la série L et est dextrogyre.
H2C(NH3+) COOH / H2C (NH3+) COO- pKa1 = 2,4 H2C (NH3+) COO- / H2C (NH2) COO- pKa2 = 9,7. HOOC-CH2-NH3+ +
H2O =
-OOC-CH2-NH3+ +
H3O+ pKa1= 2,4
calcul de la valeur du pH : On note AH+ : HOOC-CH2-NH3+ ; AH(+ -) noté A : -OOC-CH2-NH3+ ; A- : -OOC-CH2-NH2 et [H3O+] : h AH+ + H2O = A+ H3O+ ; Ka1 = [A] h / [AH+] = 10-2,4 = 3,98 10-3. A + H2O = A- + H3O+ ; Ka2 = [A-]h / [A]= 10-9,7 = 2 10-10 conservation A : [AH+]+[A]+[A-]=0,1 ; or A majoritaire dans l'eau : [A] voisin 0,1 mol/L solution électriquement neutre : h+ [AH+] = [OH-]+[A-] hypothèse : h et [OH-] négligeable devant [AH+] et [A-] alors [AH+] =[A-] Ka1 * Ka2 = h²[A-] / [AH+] = 7,96 10-13 h²= 7,96 10-13 ; pH= 6,05. si on calcule [AH+] et [A-] on trouve : [AH+] = [A] h/Ka1 = 0,1 * 10-6,05 / 3,98 10-3 = 2,24 10-5 alors que h= 7,8 10-7 [A-] =Ka2[A]/h= 2
10-10*0,1/ 10-6,05 = 2,24
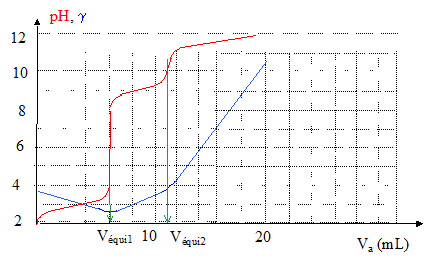
10-5 ; hypothèse confirmée La glycine est dosée par l'hydroxyde de sodium en présence d'acide chlorhydrique. Le dosage est suivi par conductimétrie et par pHmétrie. L'acide chlorhydrique est en excès par rapport à la glycine.
les ions oxonium apportés par l'acide chlorhydrique réagissent avec l'amphion et donnent HOOC-CH2-NH3+ ; l'acide chlorhydrique étant en excès il reste des ion oxonium. espèces majoritaires :
HOOC-CH2-NH3+ ;
H3O+ ; H3O+ + HO- = 2H2O HOOC-CH2-NH3+ + HO- = H2C (NH3+) COO- + H2O et si Vequi1<V<Vequi2 : H2C (NH3+)
COO- + HO- = H2C
(NH2) COO- + H2O à la première équivalence, ( dosage de l'acide chlorhydrique sous forme H3O+ et HOOC-CH2-NH3+ ) la quantité d'ion hydroxyde ajouté vaut : cbVéqui 1 = 1*6 10-3 = 6 10-3 mol. 6 10-3 = Vaca = n HCl à la seconde équivalence ( dosage de la seconde acidité de la glycine): cb(Véqui 2 -Véqui 1 ) = 1(11-6) 10-3 = 5 10-3 mol. 5 10-3 = V0c0 = 0,05 c0 d'où c0 = 0,1 mol/L. |
|
|
|
|
|
|