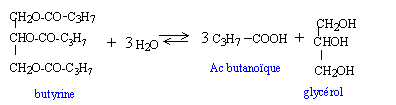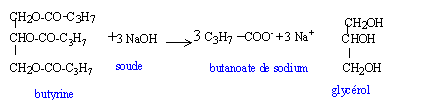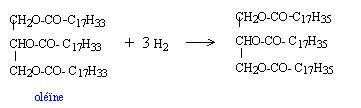|
les lipides .
|
||||||
|
||||||
|
|
au bon beurre : La butyrine est le principal constituant du beurre. La butyrine est le triester du glycérol et de l'acide butyrique ou acide butanoïque.
masse atomique molaire en g/mol : C=12 ;N=14; O=16 ; H=1; Na =23. savons "mous" : Soit un corps gras constitué de 44,2% d'oléine, 35,4 % de butyrine, et 20,4 % de palmitine (pourcentage massique)
hydrogénation : Un mélange contient 70 % d'oléine et 30 % de stéarine.
|
|||||
|
masse molaire glycérol : C3H8O3 : 92 g/mol masse (g) / masse molaire (g/mol) = 1000 / 92 = 10,87 mol masse molaire butyrine : C15 H26 O6 : 302 g/mol masse (g) = masse molaire (g/mol) * Qté de matière (mol) = 302* 10,87 = 3283 g en tenant compte du rendement 3283 / 0,85 = 3 860 g. 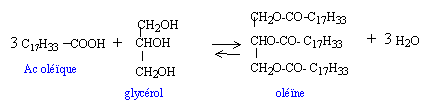
même chose en remplaçant C17 H33 par C3H7 et puis par C15 H31. le diiode se fixe sur les liaisons doubles carbone carbone seule l'oléine possède ce genre de liaisons ( 3 par molécule) une mole d'oléine peut donc fixer 3 moles de diiode I2. oléine : C57 H104 O 6 soit 884 g/mol diiode 3 fois (127+127 ) = 762 g indice d'iode : 762/884*100 = 86 masse de diiode fixée par 100 g d'oléine. or l'olèine ne représente que 44,2 % du corps gras indice d'iode du corps gras : 86/100*44,2 = 38.
on obtient également de l'oléate de sodium C17H33COONa et du palmitate de sodium C15H31COONa. masse molaire butyrate de sodium C3H7COONa : 110g/mol 60/110 = 0,545 mol donc 0,545 /3 = 0,182 mol butyrine masse molaire butyrine : 302 g/mol masse butyrine : 302*0,182 = 54,96 g. La butyrine représente 35,4 % du savon : donc 54,96 * 44,2 / 35,4 = 68,62 g d'oléine. masse molaire oléine : 884 g/mol 68,62 /884 = 0,077 mol oléine donc 3*0,077 = 0,233 mol oléate de sodium masse molaire oléate de sodium C17H33COONa : 304 g/mol masse oléate de sodium : 0,223*304 = 67,8 g.
donc 54,96 * 20,4 / 35,4 = 31,67 g de palmitine masse molaire la palmitine : 806 g/mol 31,67 /806 = 0,0392 mol palmitine donc 3*0,0392 = 0,118 mol palmitate de sodium masse molaire palmitate de sodium C15H31COONa : 278 g/mol masse palmitate de sodium : 0,118*278 = 32,8 g. masse totale savon : 32,8 + 67,8 + 60 = 160,6 g. hydrogénation :
la stéarine, triglycéride du glycérol et de l'acide stéarique C17H35COOH ne posséde pas de double liaisons carbone carbone. Seule l'oléine fixe le dihydrogène et se transforme en stéarine. masse oléine : 5000*0,7 = 3500 kg Qté de matière oléine : 3500 / 884 = 3,959 mol donc 3 * 3,959 = 11,877 mol dihydrogène volume H2 : 11,877 * 24 = 285 L. masse de stéarine obtenue : masse molaire stéarine 884+6 = 890 g/mol masse stéarine obtenue à partir de l'oléine : 890*3,959 = 3523,8 g.
|
||||||
|