|
acide faible ; acide fort dosés par la soude base faible, base forte dosées par un acide fort En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
on dissout 3,0.10-2g.d'acide acétique (CH3COOH) dans un 1/2 verre litre d'eau. Le pH de la solution est égal à 4,05.
données : pKa(CH3COOH / CH3COO- )= 4,8 corrigé |
|||||
|
produit ionique de l'eau : [HO-] = 10-14 / 10-4,05 = 1,12 10-10 mol/L acide acétique noté AH : masse molaire 60g/mol masse / masse molaire : 0,03/60 = 5 10-4 mol = 0,5 mmol puis diviser par le volume du verre d'eau en litre : soit C la concentration de l'acide conservation élément carbone : [AH]+[A-]= C la solution est électriquement neutre avec HO- négligeable [H3O+] = [A-] écrire la définition de la constante d'acidité Ka = [A-][H3O+] / [AH] [AH] = [A-][H3O+]
/ Ka = (8,9 10-5)² / 10-4,8 = 5 10-4 mol/L.
soude : 2,5*0,1= 0,25 mmol en défaut (il y a 0,5 mmol d'acide initialement) le dosage acide faible-base forte est arrêté à la demi équivalence donc pH=pKa = 4,8 , solution tampon Na+ : 0,25 mmol ; A- : 0,25 mmol ; AH : 0,25 mmol
|
||||||
|
On dose 2 solutions acides A1H et A2H (l'une est une solution d'acide fort, l'autre une solution d'acide faible) par la même solution de soude. Le volume des 2 solutions acides est égal à 25 mL. La concentration de la solution de soude est égale à 1mol/L. Les volumes de soude à l'équivalences sont respectivement V1 = 10 mL et V2 = 14 mL. 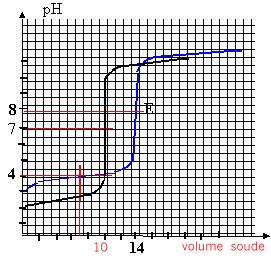
AH + HO- --> A- + H2O à l'équivalence CaVa = CbVb pour l'acide n°1 : 25 C1 = 10*1 d'où C1 = 0,4 mol/L pour l'acide n°2 : 25 C2 = 14*1 d'où C2 = 0,56 mol/L la zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence. dosage acide fort base forte : (A1H ) pH=7 à l'équivalence le graphe a un seul point d'inflexion ; indicateur coloré BBT dosage acide faible base forte : pH équi >7 car la solution contient la base faible A2- à l'équivalence le graphe a 2 points d'inflexion ( équivalence et à la demi équivalence) le pH à la demi équivalence est égal au pKa. soit 3,9 dans ce cas ( acide méthanoïque) indicateur coloré : phénolphtaléine à la demi équivalence du dosage acide faible-base forte, on a une solution tampon : les quantités de matière d'acide et de base conjuguée sont identiques. on peut également préparer une solution tampon en mélangeant de 10 mL de méthanoate de sodium à 0,1 mol/L et 10 mL d'acide méthanoïque à 0,1 mol/L
|
||||||
|
On dose 2 solutions basiques B3- et B4- (l'une est une solution de base forte, l'autre une solution de base faible) par la même solution d'acide fort (HCL). Le volume des 2 solutions basiques est égal à 35 mL. La concentration de la solution de HCL est égale à 1mol/L. On obtient les 2 courbes çi-dessous. 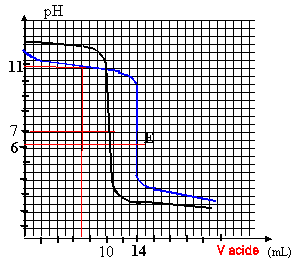
à l'équivalence CaVa = CbVb pour la base n°3 : 35 C3 = 10*1 d'où C3 = 0,286 mol/L pour la base n°4 : 35 C2 = 14*1 d'où C4 = 0,4 mol/L la zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence. dosage acide fort base forte : (B3- ) pH=7 à l'équivalence le graphe a un seul point d'inflexion ; indicateur coloré BBT dosage acide fort base faible : pH équi <7 car la solution contient l'acide faible B4H à l'équivalence le graphe a 2 points d'inflexion ( équivalence et à la demi équivalence) le pH à la demi équivalence est égal au pKa, soit 10,5 dans ce cas indicateur coloré : hélianthine à la demi équivalence du dosage acide fort-base faible B4-, on a une solution tampon : les quantités de matière d'acide et de base conjuguée sont identiques et le pH est égal au pKa du couple B4H / B4- soit 10,5. dosage base forte - acide fort avec arrêt à 7 mL d'acide versé : pH=12 d'où [H3O+] =10-12 mol/L produit ionique de l'eau :[H3O+] [HO-] = 10-14 à 25°C d'où [HO-] = 0,01 mol/L ion chlorure apporté par l'acide : [Cl-] = 7*1 / (35+7) =0,1667 mol/L base forte [B3-] = ( 35*0,286 - 7*1) / (35+7) = 0,0714 mol/L cation A+ accompagnant B3-en solution : 35*0,286 / 42 = 0,238 mol/L acide [BH] = 7*1/ 42 = 0,1667 mol/L
|
||||||
|