|
aide
technique 1998 Poitiers
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
corrigé
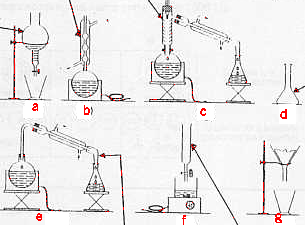
magnésium : sa combustion s'accompagne d'une lueur aveuglante, irritant les yeux méthanol : poison pour l'organisme dichromate de potassium : contient du chrome, "métaux lourds", danger pour l'environnement, toxique par ingestion conserver l'eau oxygénée à l'abri de la lumière ( évite une décomposition trop rapide en O2 et H2O). pour préparer 1 L de solution diluée : fiole jaugée de 1L pipette ou burette graduée pour mesuer 5 mL de solution mère ( 1= 5*200 = 1000 mL) pipeteur ; pissette d'eau distillée. 36,46 : masse molaire en g/mol 40% : d'acide pur dans 1L 1,19 : densité de la solution la masse de 1 L est 1190 g; cette solution contient 0,4*1190 = 476 g d'acide pur 476 / 36,46 = 13,05 mol/L. facteur de dilution : 13,05 / 0,2 = 65,27 volume de solution mère à prélever : 500 / 65,27 = 7,7 mL utiliser une pipette (+ pipeteur) ou une burette graduée pour prélever la solution mère placer dans la fiole jaugée de 500 mL compléter avec de l'eau distillée jusqu'au trait de jauge porter gants et lunettes. a : ampoule à décanter ; b : réfrigérant à eau ; c : colonne Vigreux ; d: fiole jaugée ; e : allonge coudée; f : burette graduée. montage c pour une distillation fractionnée montage b pour un chauffage à reflux montage a pour la décantation de deux liquides non miscibles de densité différente. |