- Où doit-on ranger un flacon d’acide nitrique concentré ? Comment doit-on conserver le sodium ?
- Donner les noms des composés chimiques suivants :C2H5CO2CH3 ; CH3CO2NH4 ; Na2S2O3
- Ecrire la formule de l’hydrogénocarbonate de sodium, de l’acide butanoïque, du glycérol (ou propane-1,2,3-triol).
corrigé
l'acide nitrique concentré est rangé dans le compartiment acide d'une armoire ventilée.
propanoate de méthyle : ester, chaîne de l'acide à 3 carbone
éthanoate (ou acétate) d'ammonium CH3CO2- ; NH4+
thiosulfate de sodium
NaHCO3.
CH3-CH2-CH2-COOH
CH2OH-CHOH-CH2OH
- Vous devez doser par pH-métrie une solution de carbonate de sodium de concentration proche de 0,05 mol.L -1 . Décrire le protocole permettant de préparer un litre d’une solution d’acide chlorhydrique à 0,1 mol.L -1 si vous disposez de la solution concentrée du commerce, de teneur 34% et de densité 1,17 ainsi que du matériel courant dans un laboratoire. On donne les masses molaires atomiques du chlore et de l’hydrogène :Cl = 35,5 g/mol (ou g.mol -1 ) ;H = 1,0 g/mol
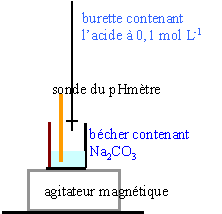
- Faire un schéma annoté du dosage par
pH-métrie de 20mL de solution de carbonate de
sodium à l’aide de la solution
préparée à la question
précédente. On obtient la courbe suivante.
Écrire les équations-bilan associées
aux réactions correspondant à chacun des
sauts de pH observés.
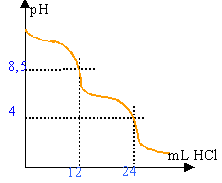
- Déduire de la courbe la concentration en CO2.
- Si vous aviez à réaliser un dosage
colorimétrique, préciser, parmi ces
indicateurs, lequel auriez-vous choisi ?
Thymolphtaléine 9,4 - 10,6;
Bleu de bromothymol 6,0 - 7,6;
Rouge de méthyle 4,8 - 6,0;
Vert de bromocrésol 3,8 - 5,4. - Etablir l’expression littérale qui aurait permis de calculer la concentration C1 de CO32- en fonction de Ca de HCl et du volume correspondant au changement de couleur, Veq .
corrigé
HCl masse molaire : 36,5 g mol-1.
1170 grammes par litre soit 1170*0,34 = 398 g HCl dissout ou 398 / 36,5 = 10,9 mol L-1.
volume pipette(mL)* concentration de la solution mère = volume fiole jaugée (mL) * concentration finale
volume pipette = 1000*0,1 /10,9 = 9,2 mL
prélever 9,2 mL à la pipette + pipeteur
placer dans fiole jaugée de 1 L
compléter avec de l'eau distillée.
CO32- + H3O+ donne HCO3- + H2O (pHE=8,5)
HCO3- + H3O+ donne CO2 + 2H2O (pHE=4)
chaque équivalence correspond à un ajout de 12 mL d'acide chlorhydrique
CaVa=CbVb d'où Cb = 0,1*12 / 20 = 0,06 mol L-1.
La zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence :
Vert de bromocrésol
CO32- +2 H3O+ donne CO2 + 3H2O
|
|
|
|
|
|
|
|
|
x=Ca Véq / 2 mol dans 20 mL ou 0,02 L
[ CO32- ] = Ca Véq / (2*0,02)= 25 CaVéq =25*0,1*0,024 =0,06 mol L-1.
On veut vérifier, par un dosage en retour - menu, la teneur en vitamine C (ou acide ascorbique) dans le jus d’orange d’une ampoule pour bébé .M (C6H8O6) = 176 g/mol
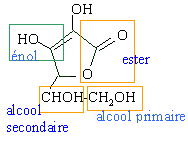
- Est ce que la vitamine C contient une fonction acide carboxylique ?
- L’oxydation utilise une solution de diiode à C1 = 5 10-3 mol.L -1 mise en excès. Le diiode I2 se dissout difficilement dans l’eau. On utilise pour le dissoudre une solution d’iodure de potassium (il se forme l’ion complexe I3 - , mais ceci ne change rien pour l’écriture des équations-bilan associées aux réactions). Vous devez préparer un litre de solution iodo-iodurée à 5 10 -3 mol.L -1 avec une solution d’iodure de potassium à 10 -2 mol.L -1 .M(I) = 126,9 g.mol -1 M(K) = 39,1 g.mol -1 . Décrire succinctement le protocole en précisant les quantités utilisées.
- Dans un becher, on introduit le contenu de
l’ampoule de jus d’orange, on la rince ; puis
on ajoute quelques gouttes d’acide phosphorique et
10mL de la solution préparée ci dessus . Le
mélange est marron-orangé. On verse
progressivement, à l’aide d’une burette
graduée, une solution de thiosulfate de sodium de
concentration C2 = 5 10 -3
mol.L -1 . Pour pH < 3, seul l’acide
ascorbique réagit avec I2 suivant la
réaction :
C6H8O6 + I2 donne C6H6O6 + 2 I - + 2 H + - Comment évolue la couleur pendant le dosage ?
- Quel est l’indicateur qui permet de repérer plus précisément l’équivalence d’oxydo-réduction ?
- Quel est alors le changement de couleur correspondant à l’équivalence d’oxydo-réduction ?
- Ecrire les demi-équations permettant de
retrouver l’équation-bilan suivante :
I2 + 2 S2O3 2 - donne S4O6 2 - + 2 I - - L’équivalence est obtenue pour 11,0 mL de thiosulfate. Calculer la quantité (en mol) de diiode en excès.
- En déduire la quantité (en mol) d’acide ascorbique et la masse correspondante contenue dans l’ampoule.
corrigé
la molécule d'acide ascorbique ne contient pas de fonction acide carboxylique.
5 mmol 254*0.005
dissoudre 1,27 g (5 mmol ou 254*0,005=1,27 g) de diiode dans 500 mL KI (0,01*0,5=0,005 mol)
puis compléter avec 500 mL d'eau distilée dans une fiole jaugée de 1 L.
Le diiode est le seul produit coloré. Au cours de la réaction ce réactif disparaît et la solution va devenir incolore.
Le diiode donne avec l'empois d'amidon une coloration bleue très foncée. A l'équivalence la couleur bleue foncée disparaît.
I2 +2e- donne 2I- réduction
2 S2O3 2 - donne S4O6 2 - +2e- oxydation.
11*0,005 = 0,055 mmol thiosulfate
0,055/2 =0,0275 mmol diiode en excès
10*0,005 =0,05 mmol I2 initial
0,05 -0,0275 = 0,0225 mmol I2 a réagi avec 0,0225 mmol acide ascorbique
soit 0,0225*176= 3,96 mg
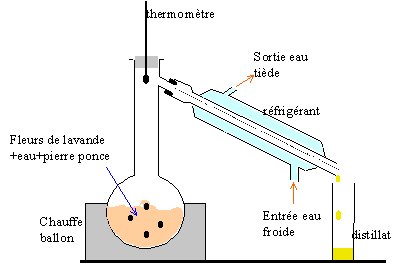
La manipulation prévoit d’extraire l’huile essentielle de lavande par hydrodistillation à partir de fleurs séchées et de faire son analyse par chromatographie sur couche mince .
- Faites un schéma annoté du montage de l’hydrodistillation.
- On ajoute du chlorure de sodium au distillat, on
agite et on verse dans une ampoule à
décanter. Quel est le rôle du chlorure de
sodium ? (cocher la case)
* Augmenter la solubilité de la phase organique par rapport à celle de la phase aqueuse.
* Diminuer la solubilité de la phase organique par rapport à celle de la phase aqueuse.
* Réagir avec les constituants de la phase organique pour les rendre plus solubles dans l’eau. - - On récupère la phase organique.
Pourquoi faut-il enlever le bouchon de l’ampoule
à décanter ? (cocher la case)
* Pour favoriser la séparation des deux liquides.
* Pour augmenter la pression à l’intérieur de l’ampoule.
* Sinon, la diminution du volume liquide entraîne une dépression dans l’ampoule et le liquide peut ne plus s’écouler. - Pour améliorer le rendement , on pourrait faire une extraction à l’éther. Quelles précautions faudrait-il alors prendre ?
- On veut vérifier si cette huile contient du bergamol, du linalol. Nommer les fonctions oxygénées présentes dans ces deux produits.
- On effectue une chromatographie sur couche mince. On
met l’éluant (dichlorométhane) dans la
cuve à chromatographie. Sur la plaque de
chromatographie, on effectue trois dépôts de
linalol(L), de bergamol (B) et d’huile essentielle
(H) dilués dans un peu de dichlorométhane.
Quelles sont les conditions à remplir pour faire
cette chromatographie ? (cocher les cases)
* Le niveau de l’éluant est supérieur au niveau des dépôts.
* Le niveau de l’éluant est inférieur au niveau des dépôts.
* La cuve de chromatographie doit rester ouverte.
* La cuve de chromatographie doit rester fermée.
* Il faut laisser l’éluant mouiller toute la couche de silice de la plaque.
* Il faut sortir la plaque avant que l’éluant arrive en haut.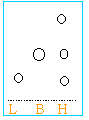
- La plaque de chromatographie est retirée et séchée. On la trempe quelques secondes dans une solution très diluée de permanganate de potassium. On obtient l’aspect suivant.Que peut-on en déduire ?
corrigé
la solubilité de l'huile de lavande diminue dans l'eau salée.
Augmenter la solubilité de la phase organique par rapport à celle de la phase aqueuse.
enlever le bouchon :
Sinon, la diminution du volume liquide entraîne une dépression dans l’ampoule et le liquide peut ne plus s’écouler.
ether liquide trés volatil et inflammable. (pas de flamme dans la salle)
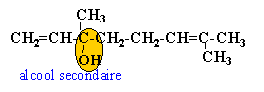
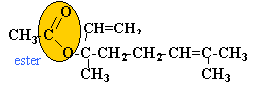
chromatographie :
Le niveau de l’éluant est inférieur au niveau des dépôts.
La cuve de chromatographie doit rester fermée.
Il faut sortir la plaque avant que l’éluant arrive en haut.
l'huile contient du linalol et du bergamol.