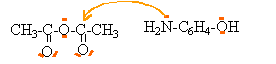| |
synthèse du paracétamol. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||||||||||||||||||||||
|
|
questions sur un protocol expérimental |
but : préparer du paracétamol, purifier le produit brut et identifier le paracétamol formé. préparation : 1. Principe Elle est réalisée à partir d’un composé A de formule (CH3 - CO)2 O et du 1-amino-4-hydroxybenzène selon la réaction d’équation-bilan (1) : (CH3 - CO)2 O + NH2 - C6H4 - OH donne CH3 - CO - NH - C6H4 - OH + CH3 - CO2H (1) Cette réaction est exothermique. 2. Protocole opératoire
Dans un erlenmeyer, on introduit successivement une masse m = 2,8 g de 1-amino-4-hydroxybenzène, 25 mL d’eau et 2 mL d’acide acétique pur. L’erlenmeyer est placé dans un bain marie à 80 °C et le mélange réactionnel est agité jusqu’à la dissolution complète. Après avoir refroidi le mélange, on introduit lentement un volume V = 3,5 mL du composé A mesuré à l’éprouvette, tout en agitant. En plaçant l’erlenmeyer dans un bain d’eau glacée, le paracétamol formé, ou paracétamol brut (PB), précipite sous forme de cristaux. Après filtration, lavage avec un peu d’eau et séchage, on pèse le paracétamol brut (PB) obtenu. Sa masse m1 est égale à 3,2 g. recristallisation : Les cristaux de paracétamol brut sont ensuite dissous dans 20 mL d’eau bouillante. La solution est ensuite refroidie dans de la glace jusqu’à la cristallisation, aussi complète que possible, du paracétamol recristallisé (PR). Après filtration, lavage à l’eau et séchage en étuve, on pèse le paracétamol recristallisé (PR). Sa masse m’1 est égale à 2,01 g. chromatographie : On réalise une chromatographie du paracétamol recristallisé (1) et de paracétamol pharmaceutique (2) avec pour éluant, un mélange (60 et 40 % en volume respectivement ) de dichlorométhane et d’éthanol.  questions
|
|||||||||||||||||||||||||||
| |
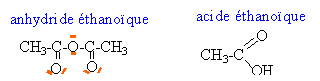
le carbone est le site électrophile et l'azote le site nucléophile.
recristallisation: purification du paracétamol en utilisant la différence de solubilité des impuretés et du paracétamol dans un solvant. chromatographie : Une seule tache pour le produit de la synthèse : donc un corps pur le rapport frontal est identique pour le témoin et le produit de la synthèse : identification du paracétamol La mesure du point de fusion permet d'identifier le produit (solide cristallisé ) de la synthèse. réactif en excès : quantité de matière d'anhydride acétique (A) : 3,5 * 1,08 = 3,78 g masse molaire A : 102 g/mol d'où : 3,78 /102 = 37 mmol 1-amino-4-hydroxybenzène : 2,8 / 109 = 25,68 mmol la réaction est équimolaire donc l'anhydride acétique est en excès. La mesure du volume de A à l'éprouvette n'est pas très précis, mais A est ajouté en excès. rendement : quantité théorique de matière du paracétamol 25,68 mmol masse molaire : 151 g/mol masse : 3,87 g rendement = masse expérimentale / masse rhéorique 2,01 / 3,87 = 0,52 ou 52%.
|
||||||||||||||||||||||||||||
|
|
|