|
acide base
: exercices de base
acide
bromhydrique
acide
chlorhydrique
hydroxyde
de baryum et acide
sulfurique.
ion
carbonate
|
|
|
|
On dispose d'une solution
commerciale d'acide bromhydrique à 46% en masse, de
densité d=1,47. Cette solution résulte de la
dissolution du bromure d'hydrogène HBr, acide fort,
dans l'eau.
- Indiquer comment
préparer, à partir de la solution
commerciale, une solution d'acide bromhydrique de
concentration c=0,1 mol.L-1.
- Quel volume de cette
dernière solution faut-il ajouter à 20 mL
d'une solution d'hydroxyde de sodium de concentration
c'=0,05 mol.L-1 pour obtenir une solution de
pH égal à 7,0?
Donnée
: M(HBr)=81 g.mol-1.
corrigé
|
|
densité par rapport
à l'eau d = 1,47
signifie :
la masse de 1 L d'acide
bromhydrique est : 1,47 kg =1470 g.
cette solution renferme
46% en masse d'acide
pur soit :
0,46 *1470 = 676,2 g HBr pur dans 1
L
puis masse (g) divisé par la
masse molaire (g/mol) :
676,2 / 81 =
8,35
mol/L.
facteur de
dilution = [solution
mère] / [solution fille diluée] =
8,35 / 0,1 = 83,5.
volume de solution fille
diluée / volume solution mère =
83,5
à prélever à
la pipette jaugée : 1000 /83,5
=12
mL de solution
concentrée
fiole jaugée de 1 L
,compléter avec eau distilée jusqu'au trait de
jauge.
dosage acide fort base
forte :
H3O+ + HO-
-->2H2O
à l'équivalence pH=7
et CaVa =CbVb
Va = 0,05*20 / 0,1 =
10
mL.
|
|
On dispose en laboratoire d'une solution d'acide
chlorhydrique ,note s0 de concentration
c0 inconnue. Afin de déterminer
c0 on applique le protocole suivant :
- On prépare 100,0 mL d'une solution d'acide
chlorhydrique, notée s1, diluée 10
fois à partir de la solution mère
s0 ;
- On prélève ensuite 20,0 mL de la solution
s1 que l'on place dans un bécher ; on
ajoute alors quelques gouttes de bleu bromothymol ( BBT )
;
-On laisse progressivement couler dans cette solution
acide une solution d'hydroxyde de sodium de concentration
0,10 mol / L jusqu'au virage de l'indicateur.
Questions :
- Etablir une liste deu materiel nécessaire
à la préparation de la solution
s1.
- Quels sont les couples acide/base mis en
évidence lors de la réaction entre l'acide
chlorhydrique et l'hydroxyde de sodium ?
- Ecrire l'equation de la réaction.
- Pourquoi est-il nécessaire de rajouté
du BBT ?
- Quelle est sa couleur avant la réaction ? Sous
quelle forme se trouve -t-il en solution ?
- Sachant qu'il a fallu verser 15mL de solution
d'hydroxyde de sodium pour que l'indicateur change de
couleur :
- Déterminer la quantite d'hydroxyde de sodium
ajouté.
- En deduire la quantite d'acide ayant réagi.
- Déterminer la concentration initiale
c0 de la solution d'acide chlorhydrique
s0.
- Quelle est la masse de chlorure d'hydrogène que
l'on a dissous dans l'eau distillée pour obtenir 1
litre de solutin s0 ?
corrigé
facteur
dilution
= 10
fiole
jaugée 100 mL
pipette
graduée 10 mL + pipeteur pour prélever la
solution mère
ajouter de
l'eau distilée jusqu'au trait de jauge
béchers
couples
acide base
:
H3O+
/ H2O pKa =0
et
H2O / HO- pKa =14
réaction
entre acide fort et base forte
:
H3O+
+ HO- donne 2 H2O
BBT :
indicateur
coloré de fin de réaction
jaune en milieu acide et bleu en milieu basique
la forme
acide de l'indicateur prédomine en milieu acide
à
l'équivalence
:
les
quantités de matière d'acide et de base mises
en présence sont dans les proportions
stoéchiomètriques.
CaVa =
CbVb
avant
l'équivalence l'un des réactifs est en
excès, après l'équivalence l'autre
réactif esten excès.
0,015 *0,1 =
0,0015 mol soude ajouté
donc 0,0015
mol acide dans 20 mL d'acide
c1
= 0,0015 / 0,020 = 0,075 mol/L
c0
= 0,75 mol/L
masse
molaire HCl =36,5 g/mol
36,5 *0,75 =
27,4
g
dissout dans 1L de solution s0.
|
|
On dispose
de 100ml de solution a 0,040 mol/L d'hydroxyde de baryum
Ba(OH)2 .
- Quelles
sont les espèces présentes dans la solution
et quelle est leur concentration molaire?
- Comment
peut on obtenir 100ml de S à 0,025mol /
Ld'hydroxyde de baryum à partir de la solution
précédente .
- On
méange les 100 mL de S avec 100mL de solution S'
d'acide sulfurique H2SO4 à
0,025mol /L;
- Ecrire les 2 équations des 2 réactions
qui ont lieu lors du mélange.
- Quelle est la quantité molaire du
précipite forme? Quelle est sa masse ?
masse atomique molaire (g/mol) : Ba=137 ; O=16 ;
S=32.
corrigé
Ba(OH)2
donne Ba2+ + 2 HO- .
ion baryum :
0,04 mol / L ; ion hydroxyde 2*0,04 = 0,08 mol / L
facteur
de dilution
: 0,04 / 0,025 = 1,6
volume de
solution mère à prélever : 100 / 1,6 =
62,5 mL ( à l'aide d'une burette)
fiole
jaugée de 100 mL et ajouter de l'eau distilée
jusqu'au trait de jauge.
réaction acide
fort base forte
: H3O+
+ HO- donne 2 H2O
préciptation
des ions sulfates sous forme de sulfate de baryum
SO42-
+ Ba2+ donne BaSO4 solide.
Qté
de matière ion sulfate : 0,1*0,025 = 0,0025
mol
Qté
de matière ion baryum : 0,1*0,025 = 0,0025
mol
proportions
stoéchiométriques, on obtient 0,0025 mol
sulfate de baryum solide.
masse
molaire BaSO4 : 137,3 + 32+ 4*16 = 233,4 mol / L
233,4 *
0,0025 = 0,58
g
de
sulfate de baryum
|
|
On dose 40 ml de solution de carbonate de sodium (
CO3 2-) par de l'acide chlorhydrique
à 0,01 mol.L-1. On suit le dosage par
pHmétrie.
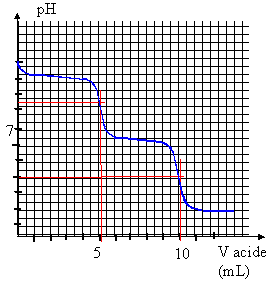
- Indiquer les réactions de dosage relatives
à chaque portion de courbe ( Couples acidobasiques
intervenant: H2CO3 / H
CO3-
(1) et H
CO3- /CO3 2-
(2)
- Le premier volume à l'équivalence est 5
mL ; le deuxième volume à
l'équivalence est 10 mL. Déterminer la
concentration en carbonate de la solution
dosée.
- Déterminer le pKa relatif au couple
(1).
- En expliquant la méthode utilisée,
déterminer le pKa relatif au couple
(2)
corrigé
le
premier
saut de pH correspond à :
CO3 2-
+ H3O+
-->
H CO3- + H2O
le
second
saut de pH correspond à :
H CO3- +
H3O+
-->
CO2 + 2H2O
A la première équivalence acide base, la
quantité de matiére d'acide ajouté est
égale à la quantité de matière
d'ion carbonate :
CaVa = CbVb
d'où Cb =[CO32-]=
5*0,01 / 40 = 1,25
10-3 mol/L.
à la 1ère demi équivalence (
2,5 mL d'acide ajouté) le pH de la solution est
égal au pKa du couple
(2)
à la 2ème demi
équivalence ( 7,5 mL d'acide ajouté) le pH de
la solution est égal au pKa du couple
(1)
retour
- menu
|