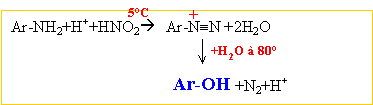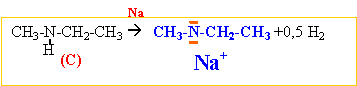. .
4 fiches de cours interactives
|
|
|
|
|
corrigé
Une base de Brönsted est
une entité susceptible de capter un proton.
NH3 et les amines sont des bases de Brönsted
et de Lewis.
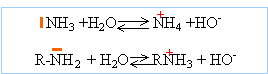
pKa du couple ion ammonium /ammoniac =9,2
Les liaisons hydrogène entre les molécules
d'ammoniac et d'eau expliquent la très grande
solubilité de l'ammoniac dans l'eau .(jusqu'à
50 moles d'ammoniac par litre d'eau à 20 °C sous
1 bar).
Plus l'atome d'azote est substitué par des
groupements donneurs d'électrons par effet inductif,
plus la densité électronique au niveau de
l'azote est grande et plus l'amine est basique.
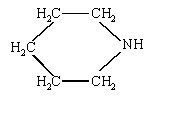
d'où : ammoniac < monoéthylamine < diéthylammine< pipéridine
Mais des effets stériques
interviennent dans le cas des amines tertiaires : ces
dernières sont les moins basiques.
Quant à l'aniline, le doublet de l'azote est
délocalisé sur le cycle benzénique
d'où une grande stabilité de l'aniline par
rapport à l'acide conjugué, l'ion anilinium.
En conséquence l'aniline oriente les substitutions électrophiles en ortho et para avec activation du cycle benzénique.
|
|
|
|
|
|
|
corrigé
La présence d'un doublet libre sur l'atome d'azote confère aux amines et à l'ammoniac des propriétés nucléophiles.
réaction d'Hoffman : SN2 puis élimination d'un proton.
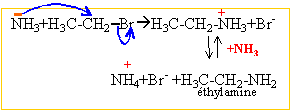
Par un mécanisme identique on obtient un mélange d'amines plus substituées et le sel d'ammonium quaternaire.
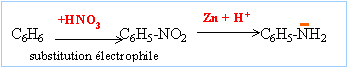
Les substitutions nucléophiles sont difficiles à réaliser sur un noyau aromatique. L'aniline n'est pas obtenue par cette méthode.
Il se forme un précipité de bromure de tétraéthylammonium
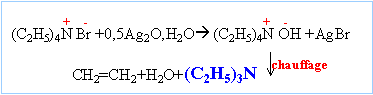
|
corrigé
Possibilité de donner l'ion amidure NH2- pour l'ammoniac
possibilité de donner R-NH- base conjuguée de R-NH2.
NH2-
+ H2O --> NH3 +
OH-
réaction totale et irréversible : l'eau est un acide plus fort que NH3.
Na (solide)+ NH3 (liquide) --->Na+
+NH2- +0,5 H2.
![]()
|
|
|
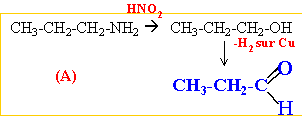
corrigé amine primaire traitée par NaNO2 +HCl à 5°C R-NH2 +
NaNO2 + HCl -->R-OH + N2
+H2O +NaCl
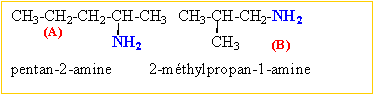
propan-1-amine, propan-2-amine C et D sont des amines secondaire et tertiaire. méthyléthylamine, triméthylamine.
retour - menu - menu |
|