Atomes, classification périodique, Lewis, moles
..
..
|
|
|
|
numéro atomique et nombre de masse
On considère un atome dont le noyau contient 30 neutrons. Son noyau a une charge égale à : 4 10-18 C. charge élémentaire e=1,6 10-19C.
- Quel est le numéro atomique de l'atome ?
- Quel est son nombre de masse A ?
- Combien d'électrons comporte cet atome ?
..
4 10-18 / 1,6 10-19= 25 protons positifs dans le noyau
L'atome est électriquement neutre : donc 25 éléctrons négatifs
Le nombre de charge ou numéro atomique , noté Z est égal à 25
Le nombre de masse noté A est égal au nombre de nucléons (protons et neutrons)
A=25+30= 55
nombre d'atomes dans une goutte de mercure
- On considère un atome de mercure (Z=80;A=200).
- Donner la masse d'un atome de mercure . Masse d'un nucléon : 1,67 10-27 kg.
- Une goutte de mercure a une masse M = 0,68 g ; calculer alors le nombre d'atomes de mercure présents dans une goutte.
..
Masse d'un atome de mercure : 200*1,67 10-27 =3,34 10-25 kg
Nombre d'atome présents dans une goutte de mecure :
0,68 10-3 /3,34 10-25 = 2 1021 atomes
utiliser la classification périodique
- Qu'est ce qu'une particule alpha ?
- Indiquer le nombre de protons , de neutrons , et d'électrons , qui composent les atomes ou ions suivants: 2H+ , 40Ar, 18 O 2- , 56 Fe3+ , 239Pu , 63Cu2+
numéro atomique: H=1 ; Ar=18 ; O=8 ; Fe=26 ; Pu=94 ; Cu =29
..
|
Z : nombre d'électrons négatifs dans l'atome ou numéro atomique (rang de X dans la classification) l'atome est électriquement neutre autant de protons que d'électrons |
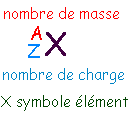 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A-Z |
|
|
|
|
|
|
|
Z - charge de l'ion |
|
|
|
|
|
|
|
|
|
|
|
|
masse volumique du noyau
Le noyau de l'atome d'hydrogène est assimilé à une sphère de rayon R=10-15m. La masse du noyau est m=1,67 10-27 kg.
- Quelle est la masse volumique du noyau de cet atome ?
- La comparer à celle du plus dense des métaux, l'uranium dont la masse volumique est voisine de 1,9 104 kg m-3.
volume d'une sphère: 4/3 pR3.
.
masse volumique kg m-3 = masse (kg)/ volume (m3)
1,67 10-27/4 10-45= 4 1017 kg m-3
soit 2 1013 fois supérieur à la masse volumique de l'uranium
propriétés du tableau périodique
Le magnésium est un élément dont le numéro atomique est égal à 12.
- Ecrire la formule électronique de l'atome de magnésium.
- Quelle est sa couche électronique externe ?
- Sur quelle ligne du tableau de la classification périodique se trouve-t-il ?
- A quelle colonne du tableau de la classification périodique appartient-il ?
- Le bérylium Be est un élément chimique placé juste en dessus du magnésium dans le tableau de la classification périodique.
- En déduire la formule électronique de l'atome de bérylium et le numéro atomique de l'élément bérylium.
- Un atome de bérylium a un nombre de masse : A = 9. Combien comporte-t-il de protons, de neutrons et d'électrons.
..
L'atome d'azote possède 12 électrons.
Sa formule électronique est :
K2L8M2
La couche externe de l'atome de magnésium est
donc la coucheM (caractérisé par le nombre
quantique n = 3).
Les éléments dont la couche électronique externe est la couche M sont situés sur la 3ème ligne (3ème période) du tableau de la classification périodique.
L'atome de magnésium possède 2 électrons sur sa couche électronique externe, l'élément magnésium est donc situé sur la 2ème colonne du tableau de la classification périodique.
L'élément bérylium est situé au dessus l'élément magnésium. Il est donc sur la 2ème colonne de la 2ème période du tableau de la classification périodique.
L'atome de bérylium possède donc 2 électrons sur sa couche électronique externe qui est la couche L (caractérisée par le nombre quantique n = 2).
Sa formule électronique est : K2L2 il possède donc 4 électrons.
Le numéro atomique de l'élément bérylium est donc Z = 4.
A = 9 ; l'atome possède 9 nucléons (protons et neutrons).
Or Z = 4 ; l'atome possède 4 protons et donc 4 électrons.
Le nombre de neutrons est donc égal à 9-4=5
élément chlore
On considère deux atomes A1 X1 et A2X2 appartenant au même élément chimique X. Cet élément se trouve sur la troisième ligne du tableau de la classification périodique.
- Quelle est le nom desa couche électronique externe ?
- A quel nombre quantique correspond cette couche ?
- Quel est le nombre maximal d'électrons que peut contenir cette couche.
- Cet élément appartient à l'avant-dernière colonne du tableau de la classification périodique.
- A quelle famille appartient-il ?
- Quel est le nombre d'électrons que possèdent les atomes de l'élément X sur leur couche externe ?
- Ecrire la formule électronique des atomes de l'élément X.
- Quel est le nombre total d'électrons que possèdent les atomes de l'élément X ?
- Quel est le nom de l'élément X ?
- Expliquer la différence entre atome et élément.
- On donne : A1 = 35 et A2 = 37. Donner la constitution des atomes X1 et X2.
- Comment appelle-t-on le rapport qui existe entre ces deux atomes ?
.
Le nombre maximum N d'électrons que peut contenir une couche caractérisée par n s'exprime : N = 2.n2.
La couche électronique M peut contenir au maximum 18 électrons.
La famille située sur l'avant dernière colonne du tableau de la classification périodique est la famille des halogènes.
Les atomes situés sur l'avant dernière colonne du tableau (septième colonne) possèdent sept électrons sur la couche électronique externe.
Formule électronique : K2 L8 M7
Les atomes de l'élément X possèdent
17 électrons.
L'élément X est
caractérisé par le numéro atomique Z =
17 (car les atomes de l'élément X
possèdent 17 protons).
Il s'agit de l'élément chlore 17Cl.
Un élément est représenté par un numéro atomique. Toutes les espèces chimiques (atome ou ion) caractérisées par le même numéro atomique appartiennent au même élément chimique.
l'atome de chlore et l'ion chlorure
appartiennent à l'élément chlore.
Atome X1 : 17 protons; 35-17=18 neutrons;
17 électrons
Atome X2 :17 protons; 37-17=20 neutrons; 17 électrons
Ces deux atomes ont le même numéro atomique (même nombre de protons) mais un nombre de masse différent (nombre de neutrons différents). Ces deux atomes sont des isotopes.
molécules; liaison covalente; formules de Lewis
- Ecrire les formules de Lewis des atomes suivants : hydrogène ; oxygène ; carbone ;azote ; soufre ; fluor.
- Définir la liaison covalente.
- Définir la valence d’un élément.
- Préciser la valence des éléments précédents.
- Ecrire les formules de Lewis des composés suivants :HF : fluorure d’hydrogène ; H2S : sulfure d’hydrogène ; CO2 : dioxyde de carbone ; CH4 : méthane ; N2 diazote; C2H4O : éthanal.
- La formule brute C2H6O correspond à deux corps différents. Ces deux corps sont des isomères, les propriétés différentes résultent d’une organisation différente des atomes dans les deux molécules. Ecrire les formules de Lewis correspondant à ces deux isomères.
.
![]()
La liaison covalente entre deux atomes correspond à une mise en commun d’une paire d’électrons. Cette paire d’électrons constitue un doublet de liaison .
La valence d’un élément est le nombre de liaisons covalentes que doit former l’atome de cet élément.
En général les atomes forment des liaisons covalentes de façon que la couche électronique externe possède 8 électrons.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La liaison double est la mise en commun de deux paires d’électrons. La liaison triple est la mise en commun de trois paires d’électrons.
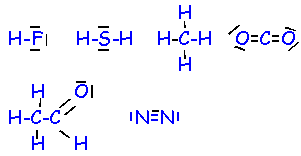
La molécule de formule brute C2H6O est formée de deux atomes de carbone, six atomes d’hydrogène et d’un atome d’oxygène. En respectant les valences de ces éléments on peut écrire de deux manières la formule de Lewis ce qui correspond à deux isomères.
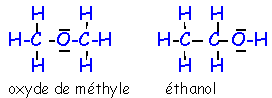
mole; masse molaire; volume molaire
- On donne, pour le fer :masse molaire M = 56 g.mol-1 ;masse volumique r = 7800 kg. m-3.
- Déterminer le volume d’un morceau de fer de masse 150 g.
- Quelle est la quantité de matière contenue dans ce morceau de fer ?
- On donne pour l’aluminium et le cuivre la masse molaire M et la masse volumique r à l’état solide. Al: 27 gmol-1; r=2700 kg m-3; Cu: 63,5 gmol-1; r=8900 kg m-3;
- Déterminer pour chaque métal le volume molaire ( volume d'une mole) à l’état solide.
- On considère trois
flacons qui contiennent à la même
température, et sous une même pression un
même volume de gaz. On a déterminé la
masse de chaque gaz. Les résultats sont
groupés dans le tableau ci-dessous
:
gaz formule volume (L) masse (g) dioxygène O2 1,5 2,01 méthane CH4 1,5 1,01 dioxyde de carbone CO2 1,5 2,78
- Calculer la masse molaire de chaque gaz.
- Déterminer la quantité de matière de chaque gaz.
- En déduire le volume molaire de chaque gaz. Quelle est la loi vérifiée par cette expérience ? Enoncer cette loi. C = 12; O=16; H=1 g.mol-1 ;
..
0,15/7800= 1,92 10-5 m3 = 1,92 10-2 L =19,2 cm3.
Qté de matière (mol)=masse (g) / masse molaire (gmol-1)
150/56= 2,68 mol
0,027/2700= 10-5 m3 = 10-2 L =10 cm3.
0,0635/8900= 7,1
10-6 m3 = 7,1 10-3 L
=7,1 cm3.
(Lmol-1)
Ces trois gaz ont donc le même volume molaire
Ces résultats sont en accord avec la loi d’Avogadro Ampère.
Dans les mêmes conditions (même température et même pression) le volume molaire est le même pour tous les gaz.
un petit cube en aluminium
La quantité de matière (mol) contenue dans un petit cube d'aluminium de coté c, est égale à 0,8 mol. La masse volumique de ce métal est 2700 kg m-3. Al=27 gmol-1.
- calculer la masse, puis le volume et enfin le coté du cube.
.
0,8*27=21,6 g
volume(m3)=masse(kg)/ masse volumique (kg m-3)
21,6 10-3 /2700=8 10-6 m3= 8 cm3.
le coté du cube mesure 2 cm.
une petite bille en fer
La quantité de matière (mol) contenue dans une petite bille de fer de rayon r, est égale à 4,67 mol. La masse volumique de ce métal est 7800 kg m-3. Fe=56 gmol-1.
- Calculer la masse, puis le volume et enfin le rayon de la bille.(volume=4/3pr3 )
..
4,67*56=261,2 g
volume(m3)=masse(kg)/ masse volumique (kg m-3)
0,2612 /7800=3,349 10-5 m3= 33,49 cm3.
33,52 cm3 =4/3 *3,14*rayon au cube (rayon en cm)
rayon au cube voisin de 8 cm3
le rayon de la bille mesure: 2 cm